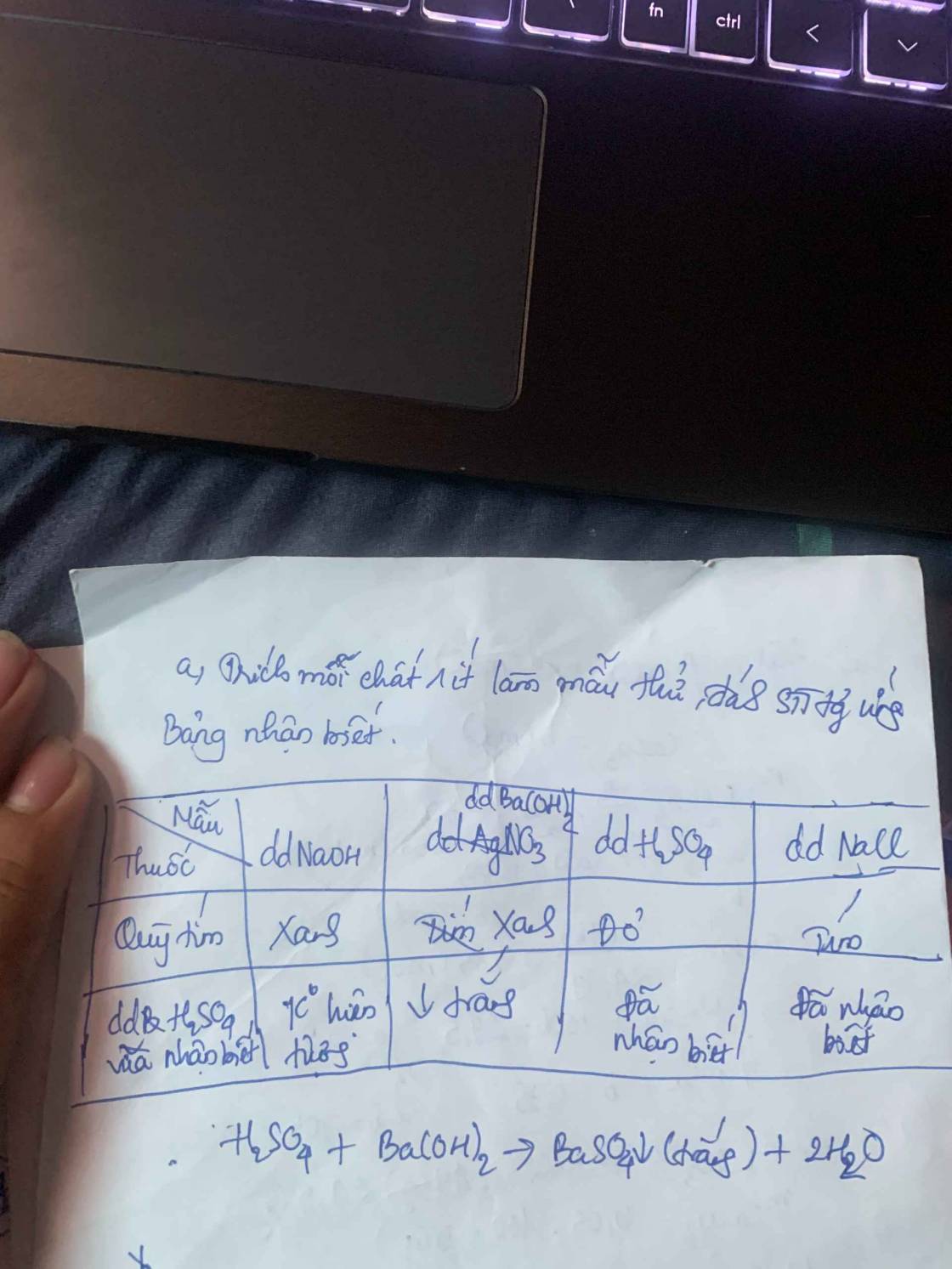
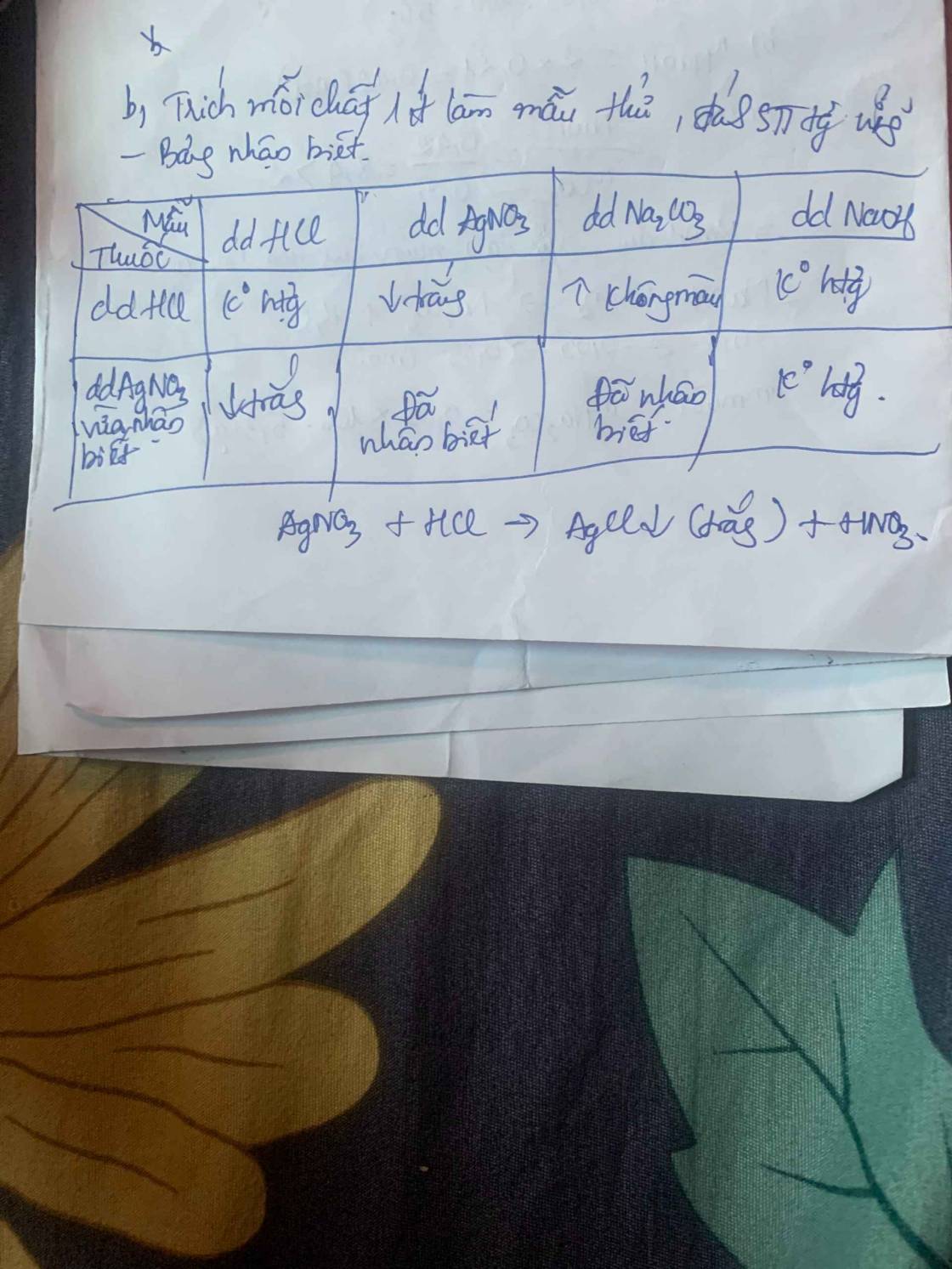
Câu 3: Trộn 200ml dd HCL 0,5M vào 50ml dd K2CO3 0,8M thì thu được V lit khí (đkc) và dd X. Tính V và CM các ion trong dd X. dd X.
Bài 1: Sự điện li
\(n_{HCl}=0,2.0,5=0,1mol\\ n_{K_2CO_3}=0,05.0,8=0,04mol\\ 2H^++CO_3^{2-}->H_2O+CO_2\\ n_{H^+dư}=0,1-0,08=0,02mol\\ C_{M\left(K^{^+}\right)}=\dfrac{0,08}{0,25}=0,32M\\ C_{M\left(H^{^+}dư\right)}=\dfrac{0,02}{0,25}=0,08M\\ C_{M\left(Cl^{^{ }-}\right)}=\dfrac{0,1}{0,25}=0,4M\)
Đúng 1
Bình luận (0)
Trung hoà 300ml dung dịch NaOH 1,5M cần dùng 200ml dung dịch chứa HCl xM và \(H_2SO_4\) 0,5M , thu được dung dịch X. Tính nồng độ mol các ion trong X.
\(n_{OH^-}=n_{NaOH}=0,3.1,5=0,45\left(mol\right)\\ n_{H^+}=n_{HCl}+2n_{H_2SO_4}=0,2x+0,5.0,2.2=0,2x+0,2\left(mol\right)\)
PT ion rút gọn: \(H^++OH^-\rightarrow H_2O\)
0,45<---0,45
\(\Rightarrow0,2x+0,2=0,45\Leftrightarrow x=1,25M\)
Ta có: \(V_{dd}=0,3+0,2=0,5\left(l\right)\) và \(\left\{{}\begin{matrix}n_{Na^+}=0,45\left(mol\right)\\n_{Cl^-}=0,2.1,25=0,25\left(mol\right)\\n_{SO_4^{2-}}=0,2.0,5=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}C_{Na^+}=\dfrac{0,45}{0,5}=0,9M\\C_{Cl^-}=\dfrac{0,25}{0,5}=0,5M\\C_{SO_4^{2-}}=\dfrac{0,1}{0,5}=0,2M\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Tính PH của dung dịch chứa hỗn hợp axit hoặc bazơ mạnh a.Tính PH của dung dịch chứa hỗn hợp HCL 0,003M và H2SO4 0,002M b.Tính PH của dung dịch chứa hỗn hợp NaOH 0,0001 và Ba(OH)2 0,0001M
a, Ta có: \(\left[H^+\right]=\left[HCl\right]+2\left[H_2SO_4\right]=0,003+2.0,002=0,007\left(M\right)\)
\(\Rightarrow pH=-log\left(0,007\right)\approx2,155\)
b, Ta có: \(\left[OH^-\right]=\left[NaOH\right]+2\left[Ba\left(OH\right)_2\right]=0,0001+2.0,0001=0,0003\left(M\right)\)
\(\Rightarrow pH=14-\left[-log\left(0,0003\right)\right]\approx10,477\)
Đúng 2
Bình luận (0)
Dung dịch X chứa Bacl2 0.05M và HCl 0.10M Bỏ qua sự điện li của nước a, viết phương trình điện li của các chất trong X b, tính. Nồng độ mol/l của các ion trong X
a, PT: \(BaCl_2\rightarrow Ba^{2+}+2Cl^-\)
\(HCl\rightarrow H^++Cl^-\)
b, [Ba2+] = 0,05 (M)
[Cl-] = 0,05.2 = 0,1 (M)
[H+] = [Cl-] = 0,1 (M)
Đúng 1
Bình luận (0)
Dung dịch A chứa Na+ 0,1 mol , Mg2+ 0,05 mol , SO42- 0,04 mol còn lại là Cl- . Tính khối lượng muối trong dung dịch
ta có
nNa++nMg2+=nSO42-+nCl-
=>0,1+2.0,05=0,04.2+nCl-
=>nCl-=0,12 mol
=>m muối=0,1.23+0,05.24+0,04.96+0,12.35,5
=11,6g
Đúng 0
Bình luận (0)
Trộn 300ml dd NaOH 0,002M với 500ml Ba(OH)2 0,001M. Tính pH sau khi trộn
\(n_{OH^-}=n_{NaOH}+n_{Ba\left(OH\right)_2}.2=0,3.0,002+0,5.2.0,001=1,6.10^{-3}\left(mol\right)\\ \left[OH^-\right]=\dfrac{1,6.10^{-3}}{0,3+0,5}=2.10^{-3}\left(M\right)\\ \Rightarrow pH=14+log\left[OH^-\right]=14+log\left[2.10^{-3}\right]=11,30103\)
Đúng 2
Bình luận (0)
Trộn 200ml dd HCl 0,01M với 300ml dd HNO3 0,01M. Tính pH sau khi trộn
\(n_{H^+}=n_{HCl}+n_{HNO_3}=0,2.0,01+0,3.0,01=0,005\left(mol\right)\\ \left[H^+\right]=\dfrac{0,005}{0,2+0,3}=0,01\left(M\right)\\ pH=-log\left[H^+\right]=-log\left[0,01\right]=2\)
Đúng 1
Bình luận (0)
Giúp tớ với
Giúp tớ với
Để được dung dịch chứa các ion: Mg2+ (0,02 mol),Fe2+ (0,03 mol), Cl- (0,04 mol), So4 2- (0,03 mol), ta có thể pha vào nước mấy muối?Là những muối nào?Bao nhiêu mol?
Ta thấy :
$n_{Cl^-} = 2n_{Mg^{2+}}$ và $n_{Fe^{2+}} = n_{SO_4^{2-}}$
Do vậy, ta có thể pha vào nước hai muối : $MgCl_2, FeSO_4$
$n_{MgCl_2} = n_{Mg^{2+}} = 0,02(mol)$
$n_{FeSO_4} = n_{Fe^{2+}} = 0,03(mol)$
Đúng 1
Bình luận (0)