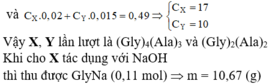Đót cháy m1 gam lưu huỳnh cần m2 gam khí Oxi, thu được 8,96 lít khí SO2(đktc). Tính m1 và m2
PT
Những câu hỏi liên quan
Đốt cháy hoàn toàn m1 gam khí ãetilen(C2H2) cần V lít khí oxi(đktc) thu được 11,2 lít khí Co2(đktc) và m2 gam H2O. Tính m1+m2 và V
C2H2 + \(\frac{5}{2}\)O2 => (to) 2CO2 + H2O
0.25 0.625 0.5 0.25 (mol)
nCO2 = V/22.4 = 11.2/22.4 = 0.5 (mol);
m1 = n.M = 0.25 x 26 = 6.5 (g);
m2 = n.M = 0.25 x 18 = 4.5 (g);
m1 + m2 = 6.5 + 4.5 = 11 (g);
V = VO2 = n.22.4 = 0.625x22.4=14(l)
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn m1 gam khí etilen(C2H4) cần 7,84 lít khí oxi (đktc) thu được m2 lít khí CO2(đktc) và m3 gam H2O. Tính m1+m2+m3
Đốt cháy 19,2 gam đồng cần V lít khí oxi(đktc) thu được m1 gam CuO. Hòa tan toàn bộ lượng CuO ở trêm vào dung dịch chứa m2 gam HCL vừa đủ. Tính V,m1,m2
nCu=0,3mol
pthh: 2Cu+O2=> 2CuO
0,3->0,15->0,3
=> m1=0,3.80=24g
=> v=0,15.22,4=3,36l
CuO+2HCl=>CuCl2+H2O
0,3->0,6
=> m2=0,6.36,5=21,9g
Đúng 0
Bình luận (0)
nCuO = 19,2 : 64 = 0,3 mol
PTHH: 2Cu + O2 ===> 2CuO
0,3 0,15 0,3 (mol)
CuO + 2HCl ===> CuCl2 + H2O
0,3 0,6 (mol)
Lập tỉ lệ các số mol theo pt, ta có:
V = 0,15 x 22,4 = 3,36 lít
m1 = 0,3 x 80 = 24 gam
m2 = 0,6 x 36,5 = 21,9 gam
Đúng 0
Bình luận (0)
Đốt cháy 16 gam lưu huỳnh cần V1 lít khí Oxi(đktc) thu được V2 lít khí SO2(đktc) Tính V1 và V2
nS=0.5(mol)
S+O2->SO2
Theo pthh nS=nO2=nSO2->nS=nO2=nSO2=0.5(mol)
->V1=V2=11.2(l)
Đúng 0
Bình luận (0)
Nhiệt phân hoàn toàn m1 gam muối KClO3 ở trên, thu toàn bộ khí oxi thoát ra cho vào bình kín chứa không khí sao cho tỉ lệ thể tích . Cho hỗn hợp Y chứa m2 gam cacbon và lưu huỳnh vào bình rồi đốt cháy, lượng oxi trong bình vừa đủ để cháy hết Y. Sau phản ứng thu được hỗn hợp khí Z gồm 3 khí, trong đó khí SO2 chiếm 20% về thể tích.a) Tìm tỉ khối của khí Z đối với H2.b) Đưa nhiệt độ trong bình về 0 độ C, áp suất 760mmHg thì khí Z có thể tích là 13,44 lít. Tính m1, m2. Cho rằng không khí chứa 80% n...
Đọc tiếp
Nhiệt phân hoàn toàn m1 gam muối KClO3 ở trên, thu toàn bộ khí oxi thoát ra cho vào bình kín chứa không khí sao cho tỉ lệ thể tích . Cho hỗn hợp Y chứa m2 gam cacbon và lưu huỳnh vào bình rồi đốt cháy, lượng oxi trong bình vừa đủ để cháy hết Y. Sau phản ứng thu được hỗn hợp khí Z gồm 3 khí, trong đó khí SO2 chiếm 20% về thể tích.
a) Tìm tỉ khối của khí Z đối với H2.
b) Đưa nhiệt độ trong bình về 0 độ C, áp suất 760mmHg thì khí Z có thể tích là 13,44 lít. Tính m1, m2. Cho rằng không khí chứa 80% nitơ và 20% oxi về thể tích.
gfvfvfvfvfvfvfv555
Đốt cháy m1 gam sắt bằng m2 gam khí oxi(đktc) thu được m3 gam Fe3O4. Hòa tan lượng Fe3O4 ở trên vào dung dịch chứa 21,9 gam HCL vừa đủ. Tính m1,m2,m3
3Fe+2O2->Fe3O4
Fe3O4+8HCl->2FeCl3+FeCl2+4H2O
nHCl=0.6(mol)
->nFe3O4=0.075(mol)->m3=17.4(g)
nFe=0.225(mol)->m1=12.6(g)
nO2=0.15(mol)
m2=4.8(g)
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 9,2g một hợp chất hưũ cơ X bằng 13,44 lít khí oxi ( đktc) vừa đủ. Sau pư thu đc m1 gam CO2 và m2 gam H2O . Biết m1:m2 = 44:27. Công thức đơn giản nhất cua X là?
Xem chi tiết
X + O2 → CO2 + H2O
Gọi số mol CO2 và H2O lần lượt là x và y mol
=> mCO2 = 44x gam và mH2O = 18y gam
Áp dụng ĐLBT khối lượng ta có : mX + mO2 = mCO2 + mH2O
=> 9,2 + \(\dfrac{13,44.32}{22,4}\)= 44x + 18y (1)
Mà mCO2 : mH2O = 44:27
=> 44x.27 = 18y.44 <=> 1188x - 792y = 0 (2)
Giải hệ pt từ (1) và (2) ta được x = 0,4 và y = 0,6
=> nC = nCO2 = 0,4 mol
nH = 2nH2O = 0,6.2 = 1,2 mol
=> mC + mH = 0,4.12 + 1,2.1 = 6 gam < mX
=> Trong X ngoài C và H còn có O và mO = 9,2 - 6 = 3,2 gam.
<=> nO = 3,2:16 = 0,2 mol
Gọi CTĐGN của X là CxHyOz
x : y : z = nC : nH : nO = 0,4 : 1,2 : 0,2 = 2 : 6 : 1
=> CTĐGN của X là C2H6O
Đúng 0
Bình luận (0)
Đốt cháy m gam lưu huỳnh bằng 6,72 lít khí oxi(đktc) vừa đủ, thu được V lít khí SO2(đktc). Tính m và V
nO2=0,3mol
pthh: S+O2=>SO2
0,3<-0,3->0,3
=> m=0,3.32=9,6g
V=0,3.22,4=6,72l
Đúng 0
Bình luận (0)
Hỗn hợp P gồm hai peptit mạch hở: X (CnHmN7O8) và Y (CxHyN4O5). Đốt cháy hoàn toàn 13,29 gam hỗn hợp P cần dùng vừa đủ 13,104 lít khí O2 (đktc) thu được khí CO2, H2O và 2,24 lít khí N2. Thủy phân hoàn toàn 13,29 gam P trong dung dịch NaOH dư thu được m1 gam muối của glyxin và m2 gam muối của alanin. Giá trị của m1 là A. 10,67 B. 10,44 C. 8,73 D. 12,61
Đọc tiếp
Hỗn hợp P gồm hai peptit mạch hở: X (CnHmN7O8) và Y (CxHyN4O5). Đốt cháy hoàn toàn 13,29 gam hỗn hợp P cần dùng vừa đủ 13,104 lít khí O2 (đktc) thu được khí CO2, H2O và 2,24 lít khí N2. Thủy phân hoàn toàn 13,29 gam P trong dung dịch NaOH dư thu được m1 gam muối của glyxin và m2 gam muối của alanin. Giá trị của m1 là
A. 10,67
B. 10,44
C. 8,73
D. 12,61