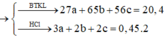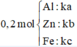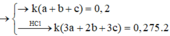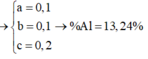Cho 3.36g hỗn hợp Al,Fe tác dụng với Cl2( ĐKTC ).Tính thể tích khí Cl2
NA
Những câu hỏi liên quan
Cho 10.7g hỗn hợp fe,Al,mg tác dụng vừa đủ với V lít khí cl2 đktc sau pư thu được 39.1g muối clorua thể tích v cần dùng
Bảo toàn khối lượng :
\(m_{Cl_2}=39.1-10.7=28.4\left(g\right)\)
\(V_{Cl_2}=\dfrac{28.4}{71}\cdot22.4=8.96\left(l\right)\)
Đúng 0
Bình luận (0)
Bài 22: Cho a gam hỗn hợp X gồm Fe và Al tác dụng hoàn toàn với dung dịch HCl dư thì thu được 11,2 lit khí ở đktc. Mặt khác, cho a gam hỗn hợp X gồm Fe và Al tác dụng vừa đủ với 13,44 lít khí Cl2 ở đktc. Tính a=?
\(n_{Cl_2}=\dfrac{13.44}{22.4}=0.6\left(mol\right)\)
\(n_{H_2}=\dfrac{11.2}{22.4}=0.5\left(mol\right)\)
\(n_{Fe}=a\left(mol\right),n_{Al}=b\left(mol\right)\)
\(n_{H_2}=a+1.5b=0.5\left(mol\right)\)
\(n_{Cl_2}=1.5a+1.5b=0.6\left(mol\right)\)
\(\Rightarrow a=b=0.2\)
\(m_X=0.2\cdot\left(56+27\right)=16.6\left(g\right)\)
Đúng 4
Bình luận (0)
Cho m gam hỗn hợp bột X gồm Fe và Cr tác dụng với dung dịch HCl loãng, dư, đun nóng thấy giải phóng 3,36 lít khí H2 (đktc). Mặt khác, khi cho m gam hỗn hợp X trên tác dụng với Cl2, đung nóng thì thể tích khí Cl2 (đktc) đã tham gia phản ứng là A. 2,24 lít B. 23,36 lít C. 5,04 lít D. 4,48 lít
Đọc tiếp
Cho m gam hỗn hợp bột X gồm Fe và Cr tác dụng với dung dịch HCl loãng, dư, đun nóng thấy giải phóng 3,36 lít khí H2 (đktc). Mặt khác, khi cho m gam hỗn hợp X trên tác dụng với Cl2, đung nóng thì thể tích khí Cl2 (đktc) đã tham gia phản ứng là
A. 2,24 lít
B. 23,36 lít
C. 5,04 lít
D. 4,48 lít
Cho 23,8 gam hỗn hợp X (Cu, Fe, Al) tác dụng vừa đủ 14,56 lít khí Cl2 (đktc). Mặt khác cứ 0,25 Mol hỗn hợp tác dụng với dung dịch HCl dư thu được 0,2 Mol khí ( đktc). Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp X.
Gọi số mol của Cu, Fe, Al trong 23,8 gam hhX lần lượt là x, y, z mol
→ mX = 64x + 56y + 27z = 23,8 (1)
\(n_{Cl_2}\) = x + 1,5y + 1,5z = 0,65 (2)
0,25 mol X + HCl → 0,2 mol H2 nên 0,2.(x + y + z) = 0,25.(y + 1,5z) (3)
Từ (1), (2), (3) => x = 0,2 mol; y = 0,1 mol; z = 0,2 mol
\(\%_{Cu} = \dfrac{0,2. 64}{23,8} \approx 53,78\%\)
\(\%_{Fe} = \dfrac{0,1 .56}{23,8} \approx 23,53\%\)
%Al ≈ 22,69%
Đúng 3
Bình luận (1)
Bài 23: Cho 23,8 gam hỗn hợp X gồm Mg, Fe và Al tác dụng hoàn toàn với dung dịch HCl dư thì thu được 17,92 lit khí ở đktc. Mặt khác, cho 23,8 gam hỗn hợp X tác dụng vừa đủ với 20,16 lít khí Cl2 ở đktc. Tính khối lượng từng chất trong hỗn hợp X?
Gọi số mol Mg, Fe, Al là a, b, c
=> 24a + 56b + 27c = 23,8
PTHH: Mg + 2HCl --> MgCl2 + H2
a------------------------->a
Fe + 2HCl --> FeCl2 + H2
b------------------------->b
2Al + 6HCl --> 2AlCl3 + 3H2
c------------------------->1,5c
=> a + b + 1,5c = \(\dfrac{17,92}{22,4}=0,8\left(mol\right)\)
PTHH: Mg + Cl2 --to--> MgCl2
a-->a
2Fe + 3Cl2 --to--> 2FeCl3
b--->1,5b
2Al + 3Cl2 --to--> 2AlCl3
c--->1,5c
=> \(a+1,5b+1,5c=\dfrac{20,16}{22,4}=0,9\left(mol\right)\)
=> a = 0,3; b = 0,2; c = 0,2
=> \(\left\{{}\begin{matrix}m_{Mg}=0,3.24=7,2\left(g\right)\\m_{Fe}=0,2.56=11,2\left(g\right)\\m_{Al}=0,2.27=5,4\left(g\right)\end{matrix}\right.\)
Đúng 3
Bình luận (0)
Cho 10,65 gam hỗn hợp X gồm Zn, Fe và Al tác dụng hoàn toàn với 200 gam dung dịch HCl a% vừa đủ thì thu được 5,04 lit khí ở đktc. Mặt khác, cho 10,65 gam hỗn hợp X tác dụng vừa đủ với 5,6 lít khí Cl2 ở đktc. Tính khối lượng từng chất trong hỗn hợp X?a. Tính phần trăm khối lượng của từng KL trong hỗn hợp ban đầu.b. Tính a?c. Tính C% các chất trong dung dịch thu được sau phản ứng.
Đọc tiếp
Cho 10,65 gam hỗn hợp X gồm Zn, Fe và Al tác dụng hoàn toàn với 200 gam dung dịch HCl a% vừa đủ thì thu được 5,04 lit khí ở đktc. Mặt khác, cho 10,65 gam hỗn hợp X tác dụng vừa đủ với 5,6 lít khí Cl2 ở đktc. Tính khối lượng từng chất trong hỗn hợp X?
a. Tính phần trăm khối lượng của từng KL trong hỗn hợp ban đầu.
b. Tính a=?
c. Tính C% các chất trong dung dịch thu được sau phản ứng.
Gọi \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Al}=c\left(mol\right)\end{matrix}\right.\) => 65a + 56b + 27c = 10,65 (1)
PTHH: Zn + 2HCl --> ZnCl2 + H2
Fe + 2HCl --> FeCl2 + H2
2Al + 6HCl --> 2AlCl3 + 3H2
=> \(n_{H_2}=a+b+1,5c=\dfrac{5,04}{22,4}=0,225\left(mol\right)\) (2)
PTHH: Zn + Cl2 --to--> ZnCl2
2Fe + 3Cl2 --to--> 2FeCl3
2Al + 3Cl2 --to--> 2AlCl3
=> \(n_{Cl_2}=a+1,5b+1,5c=\dfrac{5,6}{22,4}=0,25\left(mol\right)\) (3)
(1)(2)(3) => \(\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,05\left(mol\right)\\c=0,05\left(mol\right)\end{matrix}\right.\) => \(\left\{{}\begin{matrix}m_{Zn}=0,1.65=6,5\left(g\right)\\m_{Fe}=0,05.56=2,8\left(g\right)\\m_{Al}=0,05.27=1,35\left(g\right)\end{matrix}\right.\)
a) \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{6,5}{10,65}.100\%=61,033\%\\\%m_{Fe}=\dfrac{2,8}{10,65}.100\%=26,291\%\\\%m_{Al}=\dfrac{1,35}{10,65}.100\%=12,676\%\end{matrix}\right.\)
b) nHCl = 2a + 2b + 3c = 0,45 (mol)
=> mHCl = 0,45.36,5 = 16,425 (g)
=> \(a\%=C\%=\dfrac{16,425}{200}.100\%=8,2125\%\)
c) mdd sau pư = 10,65 + 200 - 0,225.2 = 210,2 (g)
=> \(\left\{{}\begin{matrix}C\%_{ZnCl_2}=\dfrac{0,1.136}{210,2}.100\%=6,47\%\\C\%_{FeCl_2}=\dfrac{0,05.127}{210,2}.100\%=3,02\%\\C\%_{AlCl_3}=\dfrac{0,05.133,5}{210,2}.100\%=3,176\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Cho 20,4 gam hỗn hợp A gồm Al, Zn và Fe tác dụng với dung dịch HCl dư, thu được 10,08 lít H2. Mặt khác 0,2 mol A tác dụng vừa đủ với 6,16 lít Cl2. Tính thành phần phần % về khối lượng của Al trong hỗn hợp A (biết khí đo được ở đktc) A.26,47% B. 19,85% C.33,09% D.13,24%
Đọc tiếp
Cho 20,4 gam hỗn hợp A gồm Al, Zn và Fe tác dụng với dung dịch HCl dư, thu được 10,08 lít H2. Mặt khác 0,2 mol A tác dụng vừa đủ với 6,16 lít Cl2. Tính thành phần phần % về khối lượng của Al trong hỗn hợp A (biết khí đo được ở đktc)
A.26,47%
B. 19,85%
C.33,09%
D.13,24%
Bài 7: Cho 10,65 gam hỗn hợp X gồm Zn, Fe và Al tác dụng hoàn toàn với 200 gam dung dịch HCl a% vừa đủ thì thu được 10,08 lit khí ở đktc. Mặt khác, cho 10,65 gam hỗn hợp X tác dụng vừa đủ với 5,6 lít khí Cl2 ở đktc. Tính khối lượng từng chất trong hỗn hợp X?a. Tính phần trăm khối lượng của từng KL trong hỗn hợp ban đầu.b. Tính a?c. Tính C% các chất trong dung dịch thu được sau phản ứng.
Đọc tiếp
Bài 7: Cho 10,65 gam hỗn hợp X gồm Zn, Fe và Al tác dụng hoàn toàn với 200 gam dung dịch HCl a% vừa đủ thì thu được 10,08 lit khí ở đktc. Mặt khác, cho 10,65 gam hỗn hợp X tác dụng vừa đủ với 5,6 lít khí Cl2 ở đktc. Tính khối lượng từng chất trong hỗn hợp X?
a. Tính phần trăm khối lượng của từng KL trong hỗn hợp ban đầu.
b. Tính a=?
c. Tính C% các chất trong dung dịch thu được sau phản ứng.
Bài 2: Cho 5,6 gam Fe tác dụng hết với khí Clo (Cl2) thu được hợp chất Sắt (III) clorua (FeCl3)
a/ Tính thể tích khí Cl2 (đktc) đã tham gia phản ứng
b/ Tính khối lượng FeCl3 tạo thành sau phản ứng
Cho biết: Fe = 56; Cl = 35,5
\(n_{Fe}=\dfrac{5.6}{56}=0.1\left(mol\right)\)
\(Fe+\dfrac{3}{2}Cl_2\underrightarrow{^{^{t^0}}}FeCl_3\)
\(0.1.......0.15..........0.1\)
\(V_{Cl_2}=0.15\cdot22.4=3.36\left(l\right)\)
\(m_{FeCl_3}=0.1\cdot162.5=16.25\left(g\right)\)
Đúng 6
Bình luận (0)