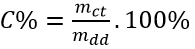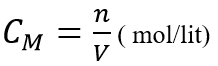tóm tắt tất cả kiến thức hình học 6 học kì II
RR
Những câu hỏi liên quan
sử dụng sơ đồ tư duy tóm tắt toàn bộ kiến thức đã học của phân môn hóa học trong chương trình học kì 1
lớp 6 ko có hóa nên cho vào sinh
ĐỀ CƯƠNG ÔN TẬP HỌC KÌ II MÔN HÓA HỌC LỚP 8Hoàn thành đề cương ra giấy ghi rõ họ tên để đi học trở lại cô sẽ thu chấm điểm các em nhé.PHẦN 1. TÓM TẮT KIẾN THỨC CƠ BẢNA. CHƯƠNG 4: OXI-KHÔNG KHÍI. TÍNH CHẤT CỦA OXI1. Tính chất vật lí2. Tính chất hóa học: Viết PT minh họa cho mỗi t/cII. SỰ OXI HÓA - PHẢN ỨNG HÓA HỢP - ỨNG DỤNG CỦA OXI1. Sự oxi hóa là gì?2. Phản ứng hóa hợp là gì?III. OXIT1. Định nghĩa ; cho vd 2. Phân loại: cho vd3. Cách gọi tên: cho vd ...
Đọc tiếp
ĐỀ CƯƠNG ÔN TẬP HỌC KÌ II MÔN HÓA HỌC LỚP 8
Hoàn thành đề cương ra giấy ghi rõ họ tên để đi học trở lại cô sẽ thu chấm điểm các em nhé.
PHẦN 1. TÓM TẮT KIẾN THỨC CƠ BẢN
A. CHƯƠNG 4: OXI-KHÔNG KHÍ
I. TÍNH CHẤT CỦA OXI
1. Tính chất vật lí
2. Tính chất hóa học: Viết PT minh họa cho mỗi t/c
II. SỰ OXI HÓA - PHẢN ỨNG HÓA HỢP - ỨNG DỤNG CỦA OXI
1. Sự oxi hóa là gì?
2. Phản ứng hóa hợp là gì?
III. OXIT
1. Định nghĩa ; cho vd 2. Phân loại: cho vd
3. Cách gọi tên: cho vd 4. công thức ?
3. Cách gọi tên: cho vd 4. công thức ?
IV. Điều chế khí oxi - Phản ứng phân hủy
1. Điều chế oxi Trong phòng thí nghiệm. viết PT minh họa
2. Phản ứng phân hủy là gì? Cho vd
V. KHÔNG KHÍ - SỰ CHÁY
1. Thành phần của Không khí2. Sự cháy và sự oxi hóa chậm
B. CHƯƠNG 5: HIDRO - NƯỚC
I. Tính chất - Ứng dụng của Hiđro 1. Tính chất vật lý 2. Tính chất hóa học: viết PT minh họa
II. Điều chế khí Hiđrơ - Phản ứng thế
1. Điều chế hidrô Trong phòng thí nghiệm 2. Phản ứng thế
III. Nước 1. Tính chất vật lý 2. Tính chất hóa học
IV. Axit - Bazơ - Muối
Nêu khái niệm, CTHH; phân loại; cách gọi tên các hợp chất và cho vd
C. CHƯƠNG 6: DUNG DỊCH
I. Dung môi – chất tan – dung dịch
II. Dung dịch chưa bão hòa. Dung dịch bão hòa
III. Độ tan của một chất trong nước Khái niệm; Công thức tính:
IV. NỒNG ĐỘ DUNG DỊCH
1. Nồng độ phần trăm: Khái niệm; Công thức tính:
2. Nồng độ mol dung dich: Khái niệm; Công thức tính:
PHẦN 2. BÀI TẬP
A. TRẮC NGHIỆM
Khoanh tròn vào một chữ cái A, B, C hoặc D đứng trước phương án chọn đúng:
1. Oxit là: A. Hợp chất của oxi với 1 nguyên tố khác
B. Hợp chất gồm 2 nguyên tố, trong đó có 1 nguyên tố là oxi.
C. Hợp chất được tạo bởi nguyên tố oxi và 1 nguyên tố nào đó.
D. Cả A, B, C đúng.
2. Oxit axit là: A. Là oxit của phi kim và tương ứng với 1 axit
B. Là oxit của kim loại và tương ứng với 1 axit
C. Là oxit của phi kim và tương ứng với 1 oxit axit
D. Thường là oxit của phi kim và tương ứng với 1 axit
3. Oxit bazơ là: A. Là oxit của phi kim và kim loại, tương ứng với 1 bazơ
B. Là oxit của kim loại và tương ứng với 1 bazơ
C. Thường là oxit của phi kim và tương ứng với 1 bazơ
D. Là oxit của phi kim và tương ứng với 1 oxit axit
4. Cho các oxit sau: SO2, SO3, Fe2O3, P2O5, K2O, NO, CO. Trong đó có mấy oxit axit
A. 4 B. 2 C. 3 D. 1
5. Cho các oxit sau: BaO, SO3, FeO, P2O5, Na2O. Trong đó có mấy oxit bazo
A. 1 B. 3 C. 2 D. 4
6. Cho các oxit có công thức hóa học sau:
CO2; NO; BaO; P2O5 ; NO2; K2O; ZnO; N2O5 ; Al2O3
a) Các oxit axit được sắp xếp như sau:
A. CO2; NO; NO2; K2O B. NO; BaO; P2O5; N2O5
C. CO2 ; P2O5 ; NO2 ; N2O5 D. BaO; P2O5; K2O; Al2O3
b) Các oxit bazơ được sắp xếp như sau:
A. BaO ; K2O; ZnO ; N2O5 B. BaO ; ZnO ; K2O ; Al2O3
C. BaO; P2O5; K2O; Al2O3 D. ZnO; N2O5; K2O; Al2O3
7. Trong các oxít sau đây, oxít nào tác dụng được với nước
A. SO3, CuO, K2O B. SO3 , K2O, CO2, BaO C. SO3, Al2O3, K2O D. N2O5, K2O, ZnO
8. Trong những chất sau đây, chất nào là axít
A. H2SiO3, H2SO4, Cu(OH)2, K2SiO3 B. HNO3, Al2O3, NaHSO4, Ca(OH)2
C. H3PO4, HNO3, H2S D. H2S, Al2O3, H2SO4, Ca(OH)2
9. Hợp chất nào dưới đây là các bazơ tan trong nước:
A. Mg(OH)2; Ba(OH)2; Al(OH)3 B. NaOH; KOH ; Ca(OH)2
C. NaOH; Cu(OH)2; AgOH D. KOH; Zn(OH)2; NaOH
10. Dãy hợp chất gồm các bazơ đều không tan trong nước:
A. Mg(OH)2; Cu(OH)2 ; Fe(OH)3 B. NaOH ; KOH ; Ca(OH)2
C. NaOH; Fe(OH)2; LiOH D. Al(OH)3; Zn(OH)2; Ca(OH)2.
11. Dung dịch làm quỳ tím hóa đỏ là:
A. H2O B. Dung dịch NaOH C. Dung dịch H2SO4 D. Dung dịch K2SO4
12. Có thể phân biệt các dung dịch axit, muối ăn, kiềm bằng cách dùng:
A. Nước cất B. Giấy quỳ tím C. Giấy phenolphtalein D. Khí CO2
13. Có những chất rắn sau: FeO, P2O5, Ba(OH)2, NaNO3. Thuốc thử được chọn để phân biệt các chất trên là:
A. dung dịch H2SO4, giấy quỳ tím. B. H2O, giấy quỳ tím.
C. dung dịch NaOH, giấy quỳ tím. D. dung dịch HCl, giấy quỳ.
14. Dãy chất nào sau đây gồm toàn muối:
A. KCl, HNO3, FeCl2, NaHCO3 B. NaNO3, Al2(SO4)3, NaOH, H2SO4
C. ZnCl2, Mg(NO3)2, KCl, H2S D. Mg(NO3)2, ZnCl2, FeCl2, AgCl.
15. Cho biết phát biểu nào dưới đây là đúng:
A. Gốc cacbonat (CO3) và sunfat (SO4) hoá trị III B. Gốc photphat (PO4) hoá trị II
C. Gốc Clorua (Cl) và Nitrat (NO3) hoá trị I D. Nhóm hiđroxit (OH) hoá trị II
16. Từ công thức hoá học Fe2O3 và H2SO4, công thức tạo bởi Fe và SO4 là:
A. FeSO4 B. Fe2(SO4)3 C. Fe(SO4)3 D. Fe3(SO4)2
17. Cho các phương trình phản ứng sau:
1. Zn + 2HCl →ZnCl2 + H2 2. 2H2O →2H2 + O2
3. 2Al + 3H2SO4 →Al2( SO4)3 + 3H2 4. 2Mg + O2 →2MgO
5. 2KClO3 →2KCl + 3O2 6. H2 + CuO →Cu + H2O 7. 2H2 + O2 →2H2O
a. Phản ứng hoá hợp là: A. 1, 3 B. 2, 5 C. 4,7 D. 3, 6
b. Phản ứng phân huỷ là: A. 5, 6 B. 2 , 5 C. 4, 5 D. 2, 7
c. Phản ứng thế là: A. 1, 3, 6 B. 1, 3, 7 C. 3, 5, 6 D. 4, 6, 7.
18. Cặp chất nào sau đây dùng để điều chế oxi trong phòng thí nghiệm:
A. H2O, KClO3 B. KMnO4, CaCO3 C. KClO3, KMnO4 D. HCl, Mg
19. Cho các khí: CO, N2, O2, Cl2, H2 .Các khí nhẹ hơn không khí là:
A. N2, H2, CO B. N2, O2, Cl2 C. CO, Cl2 D. Cl2, O2
20. Ứng dụng của hiđro là:
A. Dùng làm nguyên liệu cho động cơ xe lửa
B. Dùng làm chất khử để điều chế một số kim loại từ oxit của chúng
C. Dùng để bơm vào khinh khí cầu D. Dùng để khử trùng sát khuẩn
21. Trong phòng thí nghiệm người ta điều chế hidro bằng cách nào dưới đây:
A. Cho Zn tác dụng với dd HCl B. Điện phân nước
C. Cho K tác dụng với nước D. Cho Zn tác dụng với dd H2SO4 đặc nóng
22. Sự oxi hóa là:
A. Sự tác dụng của oxi với 1 kim loại. B. Sự tác dụng của oxi với 1 phi kim.
C. Sự tác dụng của oxi với 1 chất. D. Sự tác dụng của oxi với 1 nguyên tố hoá học.
23. Sự oxi hóa chậm là:
A. Sự oxi hóa mà không tỏa nhiệt B. Sự oxi hóa mà không phát sáng
C. Sự oxi hóa toả nhiệt mà không phát sáng D. Sự tự bốc cháy
24. Nước là hợp chất mà phân tử được tạo bởi:
A. một nguyên tử H và một nguyên tử O B. hai nguyên tử H và một nguyên tử C. hai nguyên tử H và hai nguyên tử O D. một nguyên tử H và hai nguyên tử O.
25. Để tổng hợp nước người ta đã đốt cháy hoàn toàn 2,24 lít khí hiđro ( đktc) trong oxi. Thể tích khí oxi cần dùng là:
A. 1,12 lit B. 2,24 lit C. 22,4 lit D. 11,2 lit
26. Cho H2O tác dụng vừa đủ với Na. Sản phẩm tạo ra là:
A. Na2O B. NaOH và H2 C. NaOH D. Không có phản ứng.
27. Dung dịch là hỗn hợp:
A. Của chất khí trong chất lỏng B. Của chất rắn trong chất lỏng
C. Đồng nhất của chất lỏng và dung môi D. Đồng nhất của dung môi và chất tan.
28. Khi hoà tan 100ml rượu etylic vào 50ml nước thì:
A. Rượu là chất tan và nước là dung môi B. Nước là chất tan và rượu là dung môi
C. Nước và rượu đều là chất tan D. Nước và rượu đều là dung môi
29. Khi tăng nhiệt độ và giảm áp suất thì độ tan của chất khí trong nước thay đổi như thế nào?
A. Tăng B. Giảm C. Có thể tăng hoặc giảm D. Không thay đổi
30. Trong thí nghiệm cho từ từ 2 muỗng đường vào nước. Dung dịch đường này có thể hòa tan thêm đường,
A. Dung dịch đường bão hòa B. Dung dịch đường chưa bão hòa
C. Dung dịch đồng nhất D. Cả A, B, C đều đúng
B. TỰ LUẬN
1. Hoàn thành các phản ứng hóa học sau và cho biết phản ứng nào là: phản ứng hóa hợp, phản ứng cháy, phản ứng phân hủy, phản ứng thế
a/ ……….+……… →ZnO b/ ………+ ……… →H3PO4
c/ ………+ ……… →CO2 + H2O d/ ………+ ……… →K2S
e/ H2O →……… + ……… f/ KClO3 →……… + ………
g/ ……… +……… →CuCl2 h/ KMnO4 ![]() ……… + ……… + ……….
……… + ……… + ……….
i/ Zn + HCl →……… +……… j/ Al + H2SO4 →……… + ………
k/ H2 + ……… →Cu + ……… l/ CaO + H2O →……
2. Nhiệt phân hoàn toàn 24,5g KClO3. Tính thể tích khí O2 (ở đktc) thu được?
3. Muốn điều chế được 5,6 lít O2 (ở đktc) thì khối lượng KMnO4 cần nhiệt phân là bao nhiêu?
4. Trong phòng thí nghiệm, người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng O2 oxi hóa sắt ở nhiệt độ cao. Để điều chế được 2,32g Fe3O4 cần dùng:
a) Bao nhiêu gam sắt? b) Bao nhiêu lít khí O2 (ở đktc)?
5. Đốt cháy hoàn toàn 2,7g nhôm. Tính :
a) Thể tích khí O2 (đktc) cần dùng?
b) Số gam KMnO4 cần dùng để điều chế lượng khí O2 trên?
7. Xác định công thức hóa học của nhôm oxit, biết tỉ lệ khối lượng của 2 nguyên tố nhôm và oxi bằng 9 : 8.
8. Một oxit của lưu huỳnh trong đó oxi chiếm 60% về khối lượng. Tìm công thức phân tử của oxit đó?
9. Cho 11,2 g sắt vào 200 ml dung dịch H2SO4 2M. Hãy:
a) Tính lượng khí H2 tạo ra ở đktc?
b) Chất nào còn dư sau phản ứng và lượng dư là bao nhiêu?
c) Tính nồng độ các chất sau phản ứng?
10. Cho 28,4g điphotpho pentaoxit P2O5 vào cốc chứa 90g nước để tạo thành axit photphoric. Tinh khối lượng axit H3PO4 được tạo thành ?
11. Gọi tên, phân loại các chất sau: Ca(OH)2, NaOH, KOH, Mg(OH)2, HNO3, H2SO4, HCl, H3PO4, NaCl, FeO, CuO, K2SO4, Na3PO4, AgNO3, CaSO4, NaHCO3, MgO, NaHSO4, Ca(HCO3)2, NaH2PO4
Lần sau đăng câu hỏi chia nhỏ ra nhé em !
PHẦN 1. TÓM TẮT KIẾN THỨC CƠ BẢN
A. CHƯƠNG 4: OXI-KHÔNG KHÍ
I. TÍNH CHẤT CỦA OXI
1. Tính chất vật lí
- Là chất khí không màu, không mùi, ít tan trong nước, nặng hơn không khí
- Oxi hóa lỏng ở -183°C
- Oxi lỏng có màu xanh nhạt
2. Tính chất hóa học: Viết PT minh họa cho mỗi t/c
a. Tác dụng với phi kim
PTHH: S + O2 ----to-----> SO2
PTHH: 4P + 5O2 ----to-----> 2P2O5
b. Tác dụng với kim loại
PTHH: 3Fe + 2O2 ----to-----> Fe3O4
c. Tác dụng với hợp chất:
CH4 + 2O2 ----to-----> CO2 + H2O
II. SỰ OXI HÓA - PHẢN ỨNG HÓA HỢP - ỨNG DỤNG CỦA OXI
1. Sự oxi hóa là gì?
Là sự tác dụng của oxi với một chất
2. Phản ứng hóa hợp là gì?
Phản ứng hóa hợp là phản ứng hóa học trong đó chỉ có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
Phản ứng cần nâng nhiệt độ lên để khơi mào phản ứng lúc đầu, các chất sẽ cháy, tỏa nhiều nhiệt gọi là phản ứng tỏa nhiệt.
III. OXIT
1. Định nghĩa
Oxit là hợp chất của ha nguyên tố , trong đó có một nguyên tố là oxi
VD: sắt từ oxi Fe3O4, lưu huỳnh đioxi SO2,…
2. Phân loại:
a. Oxit axit:
Thường là oxit của phi kim và tương ứng với một axit
Vd : SO3 tương ứng với axit H2SO4
CO2 tướng ứng với axit H2CO3
b. Oxit bazo
Thường là oxit của kim loại và tương ứng với một bazơ
VD: MgO tương ứng với bazo Mg(OH)2
K2O tương ứng với KOH
3. Cách gọi tên:
Tên oxit = tên nguyên tố + oxit
- Nếu kim loại có nhiều hóa trị
Tên oxit = tên kim loại (hóa trị) + oxit
VD: FeO : sắt (II) oxit
Fe2O3 : sắt (III) oxit
- Nếu phi kim có nhiều hóa trị
Tên gọi = tên phi kim + oxit
Dùng các tiền tố ( tiếp đầu ngữ) chỉ số nguyên tử
+ Mono: một
+ Đi : hai
+ Tri : ba
+ Tetra : bốn
+ Penta : năm
VD: CO: cacbon monooxit
CO2: cacbon đioxit
SO2: lưu huỳnh đioxit
SO3: lưu huỳnh trioxit
P2O3: điphotpho trioxit
P2O5 : đi photpho pentaoxit
4. công thức :
- CT chung M2Ox với x là hóa trị của chất M
- Nếu x = 2 thì có công thức là MO
Đúng 2
Bình luận (0)
IV. Điều chế khí oxi - Phản ứng phân hủy
1. Điều chế oxi Trong phòng thí nghiệm. viết PT minh họa
Trong phòng thí nghiệm
Đun nóng hợp chất giâu oxi và dễ bị phân hủy ở nhiệt độ cao như kali pemanganat KMnO4 hoặc kali clorat KClO3 trong ống nghiệm, oxi thoát ra theo PT:
2KMnO4 −to→ K2MnO4 + MnO2 + O2
2KClO3 −to→ 2KCl + 3O2
2. Phản ứng phân hủy là gì? Cho vd
Là phản ứng hóa học trong đó từ môtj chất sinh ra nhiều chất mới.
VD: 2KMnO4 −to→ K2MnO4 + MnO2 + O2
2KClO3 −to→ 2KCl + 3O2
V. KHÔNG KHÍ - SỰ CHÁY
1. Thành phần của Không khí
a. Thành phần chính
Không khí là một hỗn hợp khí trong đó oxi chiếm khoảng 1/5 thể tích. Cự thể oxi chiếm 21% thể tích, phần còn lại hầy hết là nitơ
b. Thành phần khác
Các khí khác (hơi nước, CO2, khí hiếm, bụi khói,…) chiếm tỉ lệ rất nhỏ, chỉ khoảng 1%
2. Sự cháy và sự oxi hóa chậm
a. Sự cháy
- Là sự oxi hóa có tỏa nhiệt và phát sáng
- Sự khác nhau giữa sự cháy trong oxi và trong không khí: cháy trong không khí diễn ra chậm hơn, tạo nhiệt độ thấp hơn trong oxi. Do trong không khí còn có nito với thể tích gấp 4 lần oxi, làm diện tích tiếp xúc của vật với oxi ít nên sự cháy diễn ra chậm hơn. Đồng thời, nhiệt tiêu hao còn dùng để đốt nóng khí nitơ nên nhiệt độ đạt được thấp hơn
b. Sự oxi hóa chậm
- Là sự oxi hóa có tỏa nhiệt nhưng không phát sáng
- VD: sắt để lâu trong không khí bị gỉ
- Trong điều kiện nhất định, sựu oxi hóa chậm có thể chuyển thành sự cháy
B. CHƯƠNG 5: HIDRO - NƯỚC
I. Tính chất - Ứng dụng của Hiđro
1. Tính chất vật lý
Là chất khí không màu, không mùi, không vị, nhẹ nhất trong các khí, tan rất ít trong nước
2. Tính chất hóa học: viết PT minh họa
a. Tác dụng với oxi
Nếu đốt cháy hidro trong oxi: hidro cháy mạnh, trên thành lọ xuất hiện những giọt nước nhỏ
PTHH: 2H2 + O2 −to→ 2H2O
Hỗn hợp sẽ gây nổ nếu trộng hidro và oxi theo tỉ lệ thể tích 2:1
b. Tác dụng với đồng oxit CuO
Khi đốt nóng tới khoảng 400°C : bột CuO màu đen chuyển thành lớp kim loại đồng màu đỏ gạch và có những giọt nước tạo thành trên thành cốc
PTHH: H2 + CuO −to→ Cu +H2O
⇒ Hidro đã chiến oxi trong CuO. Vậy hidro có tính khử
⇒ở nhiệt độ thích hợp, hidro có thể kết hợp với nguyên tố oxi trong một số oxit kim loại. do vậy hidro có tính khử. Các phản ứng này đều tỏa nhiệt
II. Điều chế khí Hiđrơ - Phản ứng thế
1. Điều chế hidrô Trong phòng thí nghiệm
Cho kim loại (Al, Fe, ….) tác dụng với dung dịch axit (HCl, H2SO4).
Khí H2 được thư bằng cách đẩy không khí hay đẩy nước. nhận ra khí H2 bằng que đóm đang cháy ( cháy trong không khí với ngộn lửa xanh nhạt) hoặc dùng tàn đóm ( không làm tàn đóm bùng cháy)
VD: Fe + 2HCl → FeCl2 + H2
2. Phản ứng thế
Phản ứng thế là phản ứng hóa học của đơn chất và hợp chất trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất
VD: Fe + 2HCl → FeCl2 + H2
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
III. Nước
1. Tính chất vật lý
Là chất lỏng không màu (tuy nhiên lớp nước dày có màu xanh da trời), không mùi, không vị
Sôi ở 100°C (p = 760 mmHg), hóa rắn ở 0°C
Khối lượng riêng ở 4°C là 1 g/ml (hay 1kg/lít)
Có thể hòa tan được nhiều chất rắn ( muối ăn, đường,…), chất lỏng ( còn, axit), chất khí (HCl,…)
2. Tính chất hóa học
Tác dụng với kim loại: nước có thể tác dụng với một số kim loại ở nhiệt độ thường như Ca, Ba, K,…
PTHH: K + H2O → KOH + H2
Tác dụng với mốt sô oxit bazo như CaO, K2O,… tạo ra bazo tương ứng Ca(OH)2, KOH,…
Dung dịch bazơ làm quỳ tím chuyển xanh
VD: K2O + H2O → 2KOH
Tác dụng với oxit axit như SO3, P2O5,… tạo thành axit tương ứng H2SO4, H3PO4,…
Dung dịch axit làm quỳ tím chuyển đỏ
VD: SO3 + H2O → H2SO4
IV. Axit - Bazơ - Muối
Nêu khái niệm, CTHH; phân loại; cách gọi tên các hợp chất và cho vd
1. Axit
a. Khái niệm
Phân tử axit gồm có một hay nhiều nguyên tử hihdro liên kết với gốc axit, các nguyên tử hidro này có thể thay thế bằng các nguyên tử kim loại
b. CTHH: gồm một hay nhiều nguyên tử H và gốc axit
c. Phân loại: 2 loại
- Axit không có oxi: HCl, H2S,….
- Axit có oxi: H2SO4, H2CO3,…
d. Tên gọi
- Axit không có oxi
Tên axit = axit + tên phi kim + hidric
VD: HCl: axit clohidric. Gốc axit tương ứng là clorua
H2S: axit sunfuhidric. Gốc axit tương ứng là sunfua
- Axit có oxi
+ Axit có nhiều oxi:
Tên axit = axit + tên phi kim + ic
VD: H2SO4 : axit sunfuric. Gốc axit: sunfat
HNO3: axit nitric. Gốc axit: nitrat
+ Axit có ít oxi:
Tên axit = axit + tên phi kim + ơ
VD: H2SO3 : axit sunfuro. Gốc axit sunfit
2. Bazơ
a. Khai niệm:
Phân tử bazo gồm có môt nguyên tử kim loại liên kết với một hay nhiều nhóm hidroxit (-OH).
b. CTHH: M(OH)n , n: số hóa trị của kim loại
c. Tên gọi:
Tên bazo = tên kim loại ( kèm hóa trị nếu có nhiều hóa trị) + hidroxit
VD: Fe(OH)2: sắt (II) hidroxit
KOH: kali hidroxit
d. Phân loại
Bazơ tan trong nước gọi là kiềm. VD: NaOH, KOH, Ca(OH)2, Ba(OH)2.
Bazơ không tan trong nước. VD: Cu(OH)2, Fe(OH)2, Fe(OH)3,…
3. Muối
a. Khái niệm
Phân tử muối có một hay nhiều nguyên tử kim loại liên kết với môht hay nhiều gốc axit
b. CTHH: gồm 2 phần: kim loại và gốc axit
VD: Na2SO4, CaCO3,…
c. Tên gọi
Tên muối = tên kim loại (kèm hóa trị nếu có nhiều hóa trị) + tên gốc axit
VD: Na2SO4 : natri sunfat
CaCO3: canxi cacbonat
FeSO4: sắt (II) sunfat
d. Phân loại
- Muối trung hòa: là muối mà trong gốc axit không có nguyên tử hidro có thể thay thế bằng các nguyên tử kim loại
VD: Na2SO4, CaCO3,…
- Muối axit: là muối trong đó gốc axit còn nguyên tử hidro H chưa được thay thế bằng nguyên tử kim loại. Hóa trị của gốc axit bằng số nguyên tử hidro đã được thay thế bằng các nguyên tử kim loại.
VD: NaHSO4, NaHS, NaHSO3,…
Đúng 2
Bình luận (0)
C. CHƯƠNG 6: DUNG DỊCH
I. Dung môi – chất tan – dung dịch
Dung môi là chất có khả năng hòa tan chất khác để tạo thành dung dịch.
Chất tan là chất bị hòa tan trong dung môi
Dung dịch là hỗn hợp đồng nhất của dung môi và chất tan
VD: Trong nước đường, đường là chất tan, nước là dung môi của đường, nước đường là dung dịch
II. Dung dịch chưa bão hòa. Dung dịch bão hòa
Ở một nhiệt độ xác định:
- Dung dịch chưa bão hòa là dung dịch có thể hòa thêm chất tan
- Dung dịch bão hòa là dung dịch không thể hòa thêm chất tan
III. Độ tan của một chất trong nước Khái niệm; Công thức tính:
a. Định nghĩa:
Độ tan (kí hiệu S) của một chất trong nước là số gam chất đó hòa tan trong 100g nước để tạo thành dng dịch bão hòa ở một nhiệt độ nhất định.
b.Công thức tính độ tan: S=\(\dfrac{m_{ct}}{m_{dd}}.100\)
IV. NỒNG ĐỘ DUNG DỊCH
1. Nồng độ phần trăm: Khái niệm; Công thức tính:
Nồng độ phần trăm (kí hiệu C%) của một dung dịch cho ta biết số gam chất tan trong 100g dung dịch
CT :
Trong đó: mct là khối lượng chất tan, tính bằng gam
mdd là khối lượng dung dich, tính bằng gam
khối lượng dung dịch = khối lượng chất tan + khối lượng dung môi
2. Nồng độ mol dung dich: Khái niệm; Công thức tính:
Nồng độ mol (kí hiệu CM) của dung dịch cho biết số mol chất tan trong 1 lit dung dịch
Trong đó: n : số mol chất tan
V: thể tích dung dịch (lít)
Đúng 2
Bình luận (0)
Xem thêm câu trả lời
Tổng hợp tất cả các kiến thức hình trong từng bài học trong chương trình Toán 7 học kì I phần hình
1. Hai góc đối đỉnh là hai góc mà mỗi cạnh của góc này là tia đối của một cạnh của góc kia.
- Hai góc đối đỉnh thì bằng nhau.
2. Hai đường thẳng vuông góc là hai đường thẳng cắt nhau tạo thành bốn góc vuông.
3. Đường trung trực của một đoạn thẳng là đường thẳng đi qua trung điểm và vuông góc với đoạn thẳng đó.
4. Hai đường thẳng song song là hai đường thẳng không có điểm chung. *Tính chất của hai đường thẳng song song
- Nếu đường thẳng c cắt hai đường thẳng a, b và trong các góc tạo thành có một cặp góc so le trong bằng nhau thì:
Hai góc so le trong còn lại bằng nhauHai góc đồng vị bằng nhauHai góc trong cùng phía bù nhau.*Dấu hiệu nhận biết hai đường thẳng song song
- Nếu đường thẳng c cắt hai đường thẳng a, b và trong các góc tạo thành có:
Một cặp góc so le trong bằng nhauHoặc một cặp góc đồng vị bằng nhauHoặc hai góc trong cùng phía bù nhau thì a và b song song với nhau- Hai đường thẳng phân biệt cùng vuông góc với đường thẳng thứ ba thì chúng song song với nhau.
- Hai đường thẳng phân biệt cùng song song với một đường thẳng thứ ba thì chúng song song với nhau.
5. Tiên đề ơ - clit về đường thẳng song song
- Qua một điểm ở ngoài một đường thẳng chỉ có một đường thẳng song song với đường thẳng đó.
6.Từ vuông góc đến song song
- Hai đường thẳng phân biệt cùng vuông góc với đường thẳng thứ ba thì chúng song song với nhau.
- Một đường thẳng vuông góc với một trong hái đường thẳng song song thì nó cuãng vuông góc với đường thẳng kia.
- Hai đường thẳng phân biệt cùng song song với một đường thẳng thứ ba thì chúng song song với nhau.
7. Tổng ba góc của một tam giác
- Tổng ba góc của một tam giác bằng 1800
- Trong một tam giác vuông,hai nhọn phụ nhau.
- Góc ngoài của một tam giác là góc kề bù với một góc trong của tam giác ấy.
- Mỗi góc ngoài của mmọt tam giác bằng tổng của hai góc trong không kề với nó.
8. Các trường hợp bằng nhau của hai tam giác thường
*Trường hợp 1: Cạnh – cạnh – cạnh
- Nếu 3 cạnh của tam giác này bằng 3 cạnh của tam giác kia thì hai tam giác đó bằng nhau.
*Trưòng hợp 2: Cạnh – góc – canh
- Nếu hai cạnh và góc xen giữa của tam giác này bằng hai cạnh và góc xen giữa của tam giác kia thì hai tam giác đó bằng nhau.
*Trường hợp 3: Góc – cạnh – góc
Nếu một cạnh và hia góc kề của tam giác này bằng một cạnh và hai góc kề của tam giác kia thì hai tam giác đó bằng nhau.
Hãy làm việc cùng với bạn để dự kiến nội dung ôn tập cho Bài 6, Bài 7 với cấu trúc gồm tên bài, tóm tắt bài học, các mục của bài học, nội dung trọng tâm của mỗi mục (Hình 1).
Lưu ý: phần tóm tắt bài học cần được trình bày bằng hình vẽ đồ hoạ, hình ảnh.
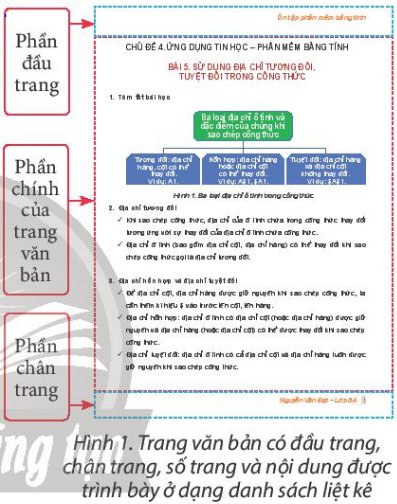
BÀI 6 SẮP XẾP, LỌC DỮ LIỆU
1. Tóm tắt bài học
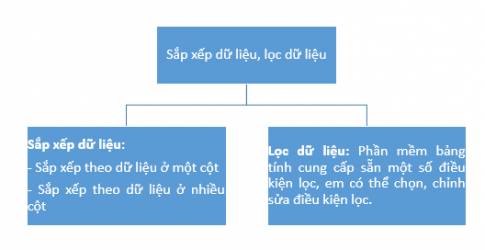
2. Sắp xếp dữ liệu
Sắp xếp theo một cột dữ liệu: Chọn một ô tính trong cột cần sắp xếp dữ liệu, nháy chọn dải lệnh ![]() hoặc
hoặc ![]() trong bảng chọn Data để sắp xếp theo thứ tự dữ liệu tăng dần hoặc giảm dần.
trong bảng chọn Data để sắp xếp theo thứ tự dữ liệu tăng dần hoặc giảm dần.
Sắp xếp theo nhiều có dữ liệu: Chọn một ô tính trong vùng dữ liệu cần sắp xếp, chọn lệnh Sort trong lệnh Sort & Filter cửa sổ Sort được mở ra. Trong cửa sổ Sort, thực hiện thêm mức sắp xếp, chọn cột, tiêu chí, cách sắp xếp sau đó chọn OK.
3. Lọc dữ liệu
Các bước lọc dữ liệu: chọn một ô tính trong vùng dữ liệu cần lọc rồi chọn thẻ Data, chọn lệnh Filter. Tiếp theo, nháy chuột vào nút mũi tên trong ô tính chứa tiêu đề cột dữ liệu cần lọc rồi chọn giá trị cần lọc hoặc chọn, chỉnh sửa điều kiện để lọc dữ liệu mong muốn, sau đó chọn OK.
Khi cần thực hiện tính toán, sắp xếp, lọc với bảng dữ liệu trong tệp văn bản, ta nên sao chép đữ liệu sang trang tính để xử lí.
Đúng 0
Bình luận (0)
Tóm tắt kiến thức hình học lớp 6 (PHẢI ĐẦY ĐỦ NHA).
Sẽ
Tick
Nếu
Đầy
Đủ
Và
Hay.
Tóm tắt kiến thức tiếng Việt mà em đã học trong học kì I theo mẫu sau:BàiKiến thức tiếng ViệtBầu trời tuổi thơMở rộng trạng ngữ trong câu bằng cụm từ:Trạng ngữ của câu có thể là từ hoặc cụm từ. Nhờ mở rộng bằng cụm từ, trạng ngữ cung cấp thông tin cụ thể hơn về không gian, thời gian,...Ví dụ:(1) Buổi sáng, cả khu vườn thơm ngát hương hoa bưởi, hoa cam, hoa chanh và hoa bạc hà, thật mát lành.(2) Buổi sáng mùa xuân, cả khu vườn thơm ngát hương hoa bưởi, hoa cam, hoa chanh và hoa bạc hà, thật mát...
Đọc tiếp
Tóm tắt kiến thức tiếng Việt mà em đã học trong học kì I theo mẫu sau:
Bài | Kiến thức tiếng Việt |
Bầu trời tuổi thơ | Mở rộng trạng ngữ trong câu bằng cụm từ: Trạng ngữ của câu có thể là từ hoặc cụm từ. Nhờ mở rộng bằng cụm từ, trạng ngữ cung cấp thông tin cụ thể hơn về không gian, thời gian,... Ví dụ: (1) Buổi sáng, cả khu vườn thơm ngát hương hoa bưởi, hoa cam, hoa chanh và hoa bạc hà, thật mát lành. (2) Buổi sáng mùa xuân, cả khu vườn thơm ngát hương hoa bưởi, hoa cam, hoa chanh và hoa bạc hà, thật mát lành. Trạng ngữ trong câu (2) mở rộng hơn so với trạng ngữ trong câu (1), cung cấp thông tin cụ thể về thời gian của sự việc được nêu trong câu |
Bài | Kiến thức tiếng Việt |
Bầu trời tuổi thơ | Mở rộng trạng ngữ trong câu bằng cụm từ: Trạng ngữ trong câu có thể là từ hoặc cụm từ, nhờ mở rộng bằng cụm từ, trạng ngữ cung cấp thông tin cụ thể hơn về không gian, thời gian,... Ví dụ: - Buổi sáng, cả khu vườn thơm ngát hương hoa bưởi, hoa cam, hoa chanh và hoa bạc hà, thật mát lành. - Buổi sáng mùa xuân, cả khu vườn thơm ngát hương hoa bưởi, hoa cam, hoa chanh và hoa bạc hà, thật mát lành. Từ mùa xuân mở rộng cho từ buổi sáng, làm rõ hơn thời gian của sự việc được nêu trong câu. Từ láy Từ láy là loại từ được tạo thành từ hai tiếng trở lên. Các tiếng có cấu tạo giống nhau hoặc tương tự nhau về vần, tiếng đứng trước hoặc tiếng đúng sau. Ví dụ: - Trời mưa xối xả. => Từ láy bộ phần. - Sấm chớp ầm ầm. => Từ láy hoàn toàn. Mở rộng thành phần chính của câu bằng cụm từ: Khi nói hoặc viết, người ta có thể dùng những cụm từ có hình thức giống câu đơn bình thường, gọi là cụm C – V, làm thành phần của câu hoặc của cụm từ để mở rộng. Ví dụ: Lá rơi cũng có thể khiến người ta giật mình. => Một tiếng lá rơi lúc này cũng có thể khiến người ta giật mình. => Câu trên được mở rộng thành phần chủ ngữ giúp cho câu văn sinh động và đầy đủ hơn. |
Khúc nhạc tâm hồn | Nói giảm nói tránh Nói giảm, nói tránh là một biện pháp tu từ dùng cách diễn đạt tế nhị, uyển chuyển, tránh gây cảm giác đau buồn, ghê sợ, nặng nề; tránh thô tục, thiếu lịch sự. Ví dụ Bác đã đi rồi sao, Bác ơi! Mùa thu đang đẹp, nắng xanh trời (Bác ơi! – Tố Hữu) - Để tránh cảm giác đau buồn, nặng nề, tác giả dùng từ “đi” cho ý thơ thêm tế nhị để nói về việc Bác Hồ kính yêu đã không còn nữa. Nghĩa của từ ngữ Nghĩa của từ là nội dung (sự vật, tính chất, hoạt động, quan hệ…) mà từ biểu thị. Ví dụ: - Trường học là một cơ quan được lập ra nhằm giáo dục cho học sinh dưới sự giám sát của giáo viên. Nhân hóa Nhân hóa là gọi hoặc tả con vật, cây cối, đồ vật… bằng những từ ngữ vốn được dùng để gọi hoặc tả con người; làm cho thế giới loài vật, cây cối, đồ vật trở nên gần gũi với con người, biểu thị những suy nghĩ, tình cảm của con người. Ví dụ - Ông Mặt Trời vừa thức giấc, chim muông đã hót líu lo trên những cánh đồng vàng. - Chị Gió ơi chị Gió ơi! Cho em đi làm mưa với! Điệp từ Điệp từ, điệp ngữ là một biện pháp tu từ trong văn học chỉ việc lặp đi, lặp lại một từ hoặc một cụm từ, nhằm nhấn mạnh, khẳng định, liệt kê, ... để làm nổi bật vấn đề khi muốn nói đến. Ví dụ Điệp ngữ cách quãng: “… Nhớ sao lớp học i tờ Đồng khuya đuốc sáng những giờ liên hoan Nhớ sao ngày tháng cơ quan Gian nan đời vẫn ca vang núi đèo Nhớ sao tiếng mõ rừng chiều Chày đêm nện cối đều đều suối xa…” Liệt kê Liệt kê là sắp xếp nối tiếp hàng loạt từ hay cụm từ cùng loại để diễn tả được đầy đủ hơn, sâu sắc hơn những khía cạnh khác nhau của thực tế hay của tư tưởng, tình cảm. Ví dụ Bầu khí quyển ngày càng nghiêm trọng: các hợp chất của các-bon làm ô nhiễm, tầng ô-zôn bao bọc trái đất bị chọc thủng, các tia tử ngoại xâm nhập vào các dòng khí quyển xuống mặt đất… |
Cội nguồn yêu thương | Số từ Số từ là những từ chỉ số lượng và thứ tự của sự vật. Khi biểu thị số lượng sự vật, số từ thường đứng trước danh từ. Khi biểu thị thứ tự, số từ đứng sau danh từ. Ví dụ - Con lợn ấy nặng cả trăm cân chứ không ít. - Học giỏi nhất lớp tôi là bạn lớp phó học tập. - Bóng của hai người bạn in trên con đường dài. Phó từ Phó từ là những từ chuyên đi kèm các động từ, tính từ để bổ sung ý nghĩa cho động từ, tính từ. Ví dụ - Chiếc xe bố vừa mua cho tôi rất đẹp và phong cách. - Tôi vô cùng ngưỡng mộ bạn lớp trưởng lớp tôi. |
Giai điệu đất nước | Ngữ cảnh và nghĩa của từ ngữ trong ngữ cảnh Tùy vào từng ngữ cảnh được nhắc tới mà các từ ngữ có thể mang nhiều nghĩa khác nhau. Ví dụ - Từ “thơm” trong từ “thơm ngon” mang nghĩa là mùi hương hấp dẫn. - Từ “thơm” trong từ “người thơm” mang nghĩa là con người có phẩm chất đẹp đẽ. So sánh So sánh là đối chiếu sự vật, sự việc này với sự vật, sự việc khác có nét tương đồng để làm tăng sức gợi hình, gợi cảm cho sự diễn đạt. Ví dụ + Những ngôi sao thức ngoài kia Chẳng bằng mẹ đã thức vì chúng con + Cô giáo em hiền như cô tiên. |
Màu sắc trăm miền | Dấu gạch ngang Dấu gạch ngang (–) là một dấu câu có hình dạng tương tự dấu gạch nối và dấu trừ nhưng khác với các ký hiệu này về chiều dài và trong một số phông chữ, chiều cao trên đường cơ sở. Ví dụ - VD 1: Đánh dấu bộ phận chú thích Lan – lớp trưởng lớp tôi đã đạt giải nhất trong kì thi này. - VD 2: Đánh dấu lời nói trực tiếp Bố thường bảo với tôi rằng: - Con muốn trở thành một người có ích thì trước tiên con phải là một cậu bé ngoan, biết yêu thương mọi người. Từ ngữ địa phương Từ ngữ địa phương là từ ngữ chỉ sử dụng ở một (hoặc một số) địa phương nhất định. Ví dụ - U (mẹ), mô (đâu), tía (cha). |
Đúng 0
Bình luận (0)
Tóm tắt lại kiến thức của bài học Tính chất chia hết của 1 tổng
gồm nhiều tính chất như
kết hợp
giao hoán
cộng với số 1
k cho mình nha
Đúng 0
Bình luận (0)
Tóm tắt kiến thức cơ cản của 3 hiđrocacbon (metan, axetilen, etilen) đã học bằng một sơ đồ tư duy
Xem chi tiết