Sục SOC nặng 3.2g khí sulfur vào bình chứa oxy không khí A) Viết PT B) Tính khối lượng sản phẩm
TT
Những câu hỏi liên quan
Đốt cháy hoàn toàn 6,2g photpho trong bình chứa khí oxi.
a. Viết PTHH và gọi tên sản phẩm
b. Tính khối lượng sản phẩm thu được
c. Tính thể tích khí oxi cần dùng ở đktc
d. Tính thể tích không khí, biết thể tích khí oxi chiếm 20% thể tích không khí.
Xem chi tiết
a)
\(4P + 5O_2 \xrightarrow{t^o} 2P_2O_5\)
Sản phẩm : Điphotpho pentaoxit.
b)
\(n_P = \dfrac{6,2}{31} = 0,2(mol)\\ \Rightarrow n_{P_2O_5} = \dfrac{1}{2}n_P = 0,1(mol)\\ \Rightarrow m_{P_2O_5} = 0,1.142 = 14,2(gam)\)
c)
\(n_{O_2} = \dfrac{5}{4}n_P = 0,125(mol)\\ \Rightarrow V_{O_2} = 0,125.22,4 = 2,8(lít)\)
d)
\(V_{không\ khí} = \dfrac{2,8}{20\%} = 14(lít)\)
Đúng 1
Bình luận (0)
Đối cháy 24,8 gam phốt pho bằng 67,2 lít không khí ở điều kiện tiêu chuẩn (không khí có chứa 20% khí oxy và 80% khí nitơ về thể tích). a) Tính khối lượng sản phẩm tạo thành? b) Tính thành phần phần trăm về khối lượng các chất có trong hỗn hợp sau phản ứng? Biết rằng khí nitơ không cháy.
$\rm a)n_{kk} = \dfrac{67,2}{22,4} = 3 (mol)$
$\rm \Rightarrow n_{O_2} = 20\%.3 = 0,6 (mol)$
$\rm n_P = \dfrac{24,8}{31} = 0,8 (mol)$
PTHH: \(\rm 4P + 5O_2 \xrightarrow{t^o} 2P_2O_5 \)
Ban đầu: 0,8 0,6
Pư: 0,48<--0,6
Sau pư: 0,32 0 0,24
$\rm \Rightarrow m_{\text{sản phẩm tạo thành}} = m_{P_2O_5(sinh.ra)} = 0,24.142 = 34,08 (g)$
$\m b) m_{hh} = m_{P(dư)} + m_{P_2O_5} = 0,32.31 + 34,08 = 44 (g)$
$\rm \Rightarrow \%m_P = \dfrac{0,32.31}{44} .100\% = 22,545\%$
$\rm \Rightarrow \%m_{P_2O_5} = 100\% - 22,545\% = 77,455\%$
Đúng 2
Bình luận (0)
\(n_P=\dfrac{24,8}{31}=0,8\left(mol\right)\)
Thể tích Oxi trong 67,2 lít không khí :
67,2 x 20% = 13,44(l)
\(n_{O_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH :
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
Trc p/ư: 0,8 0,6 (mol)
p/ư 0,48 0,6 0,24
Sau p/ư: 0,32 0 0,24
=> Sau p/ư P dư
Khối lượng sản phẩm tạo thành :
\(m_{P_2O_5}=0,24.142=34,08\left(g\right)\)
Khối lượng P trong hỗn hợp :
\(m_{P\left(P_2O_5\right)}=0,48.31=14,88\left(g\right)\)
Thành phần % của P :
\(14,88:34,08=43,66\%\)
Đúng 1
Bình luận (0)
Câu 4: Đốt cháy 6,4 gam lưu huỳnh trong bình chứa không khí ở đktc.
a. Viết phương trình hóa học
b. Đọc tên sản phẩm tạo thành và tính khối lượng là bao nhiêu gam?
c. Tính thể tích không khí cấn dùng.
a: \(S+O_2\rightarrow SO_2\)
b: Sản phẩm tạo thành là lưu huỳnh đioxit
\(n_S=\dfrac{6.4}{64}=0.1\left(mol\right)=n_{SO_2}\)
\(m_{SO_2}=0.1\cdot96=9.6\left(g\right)\)
c: \(V_{O_2}=0.1\cdot22.4=2.24\left(lít\right)\)
\(n_S=\dfrac{m_S}{M_S}=\dfrac{6,4}{32}=0,2mol\)
Sản phẩm là: Lưu huỳnh đioxit
\(S+O_2\rightarrow\left(t^o\right)SO_2\)
1 1 1 ( mol )
0,2 0,2 0,2 ( mol )
\(m_{SO_2}=n_{SO_2}.M_{SO_2}=0,2.64=12,8g\)
\(V_{O_2}=n_{O_2}.22,4=0,2.22,4=4,48l\)
\(V_{kk}=V_{O_2}.5=4,48.5=22,4l\)
S+O2-to>SO2
0,5---0,5----0,5 mol
m S=\(\dfrac{6,4}{32}\)=0,5 mol
=>SO2: lưu huỳnh đioxit
m SO2=0,5.64=32g
=>Vkk=0,5.22,4.5=56l
Đúng 3
Bình luận (0)
Đốt cháy 6,2gam photpho trong bình kín chứa đầy không khí có dư tích 18,48lit khí ở điều kiện tiêu chuẩn. Biết oxi chiếm 1/5 thể tích không khí.a) viết phương trình phản ứng. b)tính khối lượng sản phẩm thu được.
Đọc tiếp
Đốt cháy 6,2gam photpho trong bình kín chứa đầy không khí có dư tích 18,48lit khí ở điều kiện tiêu chuẩn. Biết oxi chiếm 1/5 thể tích không khí.
a) viết phương trình phản ứng.
b)tính khối lượng sản phẩm thu được.
a, PT: \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
b, Ta có: \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
\(V_{O_2}=18,48.\dfrac{1}{5}=3,696\left(l\right)\Rightarrow n_{O_2}=\dfrac{3,696}{22,4}=0,165\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{4}>\dfrac{0,165}{5}\), ta được P dư.
Theo PT: \(n_{P_2O_5}=\dfrac{2}{5}n_{O_2}=0,066\left(mol\right)\)
\(\Rightarrow m_{P_2O_5}=0,066.142=9,372\left(g\right)\)
Đúng 2
Bình luận (0)
Đốt cháy a gam hỗn hợp khí gồm CH4, C2H4, C3H8, C4H8, trong bình chứa 27,216 lít khí Oxi. Dẫn toàn bộ sản phẩm cháy vào bình chứa nước vôi trong dư thấy khối lượng bình tăng b gam và 66 gam kết tủa. Tính a và b.
Đốt 2,5g Photpho trong bình có chứa 1,4 lít không khí(đktc).
Biết oxi trong không khí chiếm 20%.
a/ Cho biết tên và công thức của sản phẩm.
b/ Tính khối lượng sản phẩm thu được
a)
\(4P + 5O_2 \xrightarrow{t^o}2P_2O_5\)
Sản phẩm : \(P_2O_5\)(điphotpho pentaoxit)
b)
\(n_{O_2} = \dfrac{1,4.20\%}{22,4} = 0,0125(mol)\\ \dfrac{n_P}{4} = \dfrac{\dfrac{2,5}{31}}{4}= 0,02 > \dfrac{n_{O_2}}{5 }=0,0025\)
Do đó,P dư
Ta có :
\(n_{P_2O_5} = \dfrac{2}{5}n_{O_2} = 0,005(mol)\\ \Rightarrow m_{P_2O_5} = 0,005.142 = 0,71(gam)\)
Đúng 4
Bình luận (0)
a) Tên sp: điphotphopentaoxit
Công thức: \(P_2O_5\)
b) \(V_{O_2}kk=1,4.20\%=0,28\left(l\right)\Rightarrow n_{O_2}=0,0125\left(mol\right)\)
Pt: \(4P+5O_2\rightarrow2P_2O_5\)
Theo pt: \(n_{P_2O_5}=\dfrac{2}{5}n_{O_2}=\dfrac{1}{200}\left(mol\right)\)
\(m_{P_2O_5}=\dfrac{1}{200}.142=0,71\left(g\right)\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 8,1 gam nhôm (Al) trong bình chứa khí O2.(a) Viết phương trình hóa học của phản ứng xảy ra.(b) Tính thểtích khí O2(ởđktc) đã tham gia phản ứng.(c) Tính khối lượng sản phẩm tạo thành.
Đọc tiếp
Đốt cháy hoàn toàn 8,1 gam nhôm (Al) trong bình chứa khí O2.(a) Viết phương trình hóa học của phản ứng xảy ra.(b) Tính thểtích khí O2(ởđktc) đã tham gia phản ứng.(c) Tính khối lượng sản phẩm tạo thành.
a. 4Al + 3O2 -> 2Al2O3
0.3 0.225 0.15
b.\(n_{Al}=\dfrac{8.1}{27}=0.3mol\)
\(V_{O_2}=0.225\times22.4=5.04l\)
c.\(m_{Al_2O_3}=0.15\times102=15.3g\)
Đúng 5
Bình luận (0)
Đốt cháy hoàn toàn 6,2g photpho trong bình chứa khí oxi a. Tính thể tích khí oxi ở đktc cần dùng b. Tính khối lượng sản phẩm tạo thành
a) \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
PTHH: 4P + 5O2 --to--> 2P2O5
0,2-->0,25------->0,1
=> \(V_{O_2}=0,25.22,4=5,6\left(l\right)\)
b) \(m_{P_2O_5}=0,1.142=14,2\left(g\right)\)
Đúng 3
Bình luận (0)
dẫn hỗn hợp a gồm 6,72 lít khí hđro và 4,48l khí clo vào trg bình kính, ngâng nhiệt độ để puhh xảy ra a, sau khi p.ứng kthuc thì trong bình chứa những chất nào? kluong bao nhiêu b,tính khối lượng sản phẩm tạo thành
Mình có một số câu hỏi :
Các số liệu trên đc đo ở điều kiện nào ? Câu a, tính khối lượng các chất tức là tính cả khối lượng của HCl thì cần gì làm câu b, nữa ???
Nếu các số liệu đc đo ở đktc thì đây
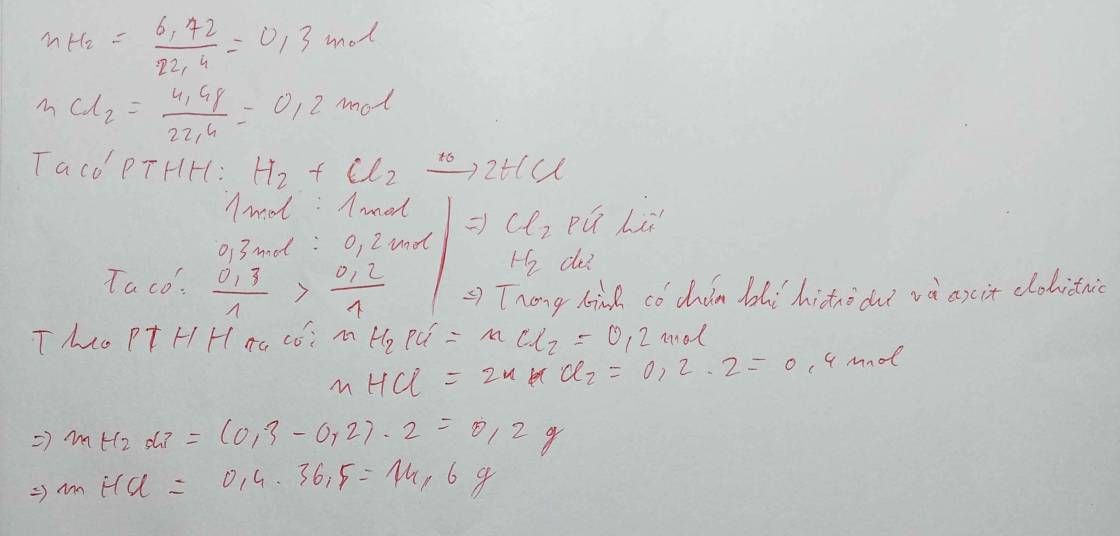
![]()
![]()
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 8,4 gam bột sắt trong không khí thu được 11,6 gam sản phẩm duy nhất oxit sắt từ Fe3O4 a viết phương trình hoá học xảy ra b tính khối lượng khí oxi cần dùng cho phản ứng trên c c tính thể tích không khí chứa đủ lượng khí oxi trên Cho rằng khí oxi chiếm 1/5 thể tích không khí đo ở điều kiện tiêu chuẩn
Xem chi tiết
a) 3Fe + 2O2 Fe3O4
b) nFe = \(\dfrac{8,4}{56}\)= 0,15 mol
nFe3O4 = \(\dfrac{11,6}{232}\) = 0,05 mol
Ta thấy \(\dfrac{nFe}{3}\)= \(\dfrac{nFe_3O_4}{1}\)=> Fe phản ứng hết
<=> nO2 cần dùng = \(\dfrac{2nFe}{3}\)= 0,1 mol
<=> mO2 cần dùng = 0,1.32 = 3,2 gam
c) Oxi chiếm thể tích bằng 1/5 thể tích không khí.
Mà V O2 = 0,1.22,4 = 2,24 lít => V không khí = 2,24 . 5 = 11,2 lít
Đúng 1
Bình luận (0)





