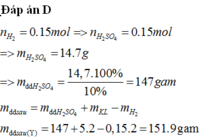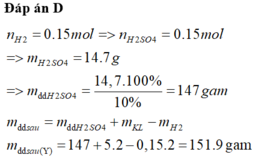Cho 5,4 gam Al tác dụng với 392 gam dung dịch H2SO4 10%. Thể tích H2 (đkc) thu được là:
H24
Những câu hỏi liên quan
Bài 4: Cho 5,4 gam Aluminium (Al) tác dụng vừa đủ với 150 gam dung dịch Sulfuric acid H2SO4 . a/ Tính thể tích khí Hydrogen (H2 ) sinh ra (ở đkc). b/Tính nồng độ phần trăm của dung dịch H2SO4. c/ Tính khối lượng muối tạo thành. Bài 5: Cho 4 gam kim loại Magnesium oxide MgO phản ứng vừa đủ với 200 gam dung dịch Hydrochloric a/ Tính nồng độ phần trăm của dung dịch HCl? b/ Tính nồng độ phần trăm của dung dịch muối thu được sau phản ứng? c/ Cần dùng bao nhiêu ml dung dịch NaOH 1M để trung hóa hết lư...
Đọc tiếp
Bài 4: Cho 5,4 gam Aluminium (Al) tác dụng vừa đủ với 150 gam dung dịch Sulfuric acid H2SO4 . a/ Tính thể tích khí Hydrogen (H2 ) sinh ra (ở đkc). b/Tính nồng độ phần trăm của dung dịch H2SO4. c/ Tính khối lượng muối tạo thành. Bài 5: Cho 4 gam kim loại Magnesium oxide MgO phản ứng vừa đủ với 200 gam dung dịch Hydrochloric a/ Tính nồng độ phần trăm của dung dịch HCl? b/ Tính nồng độ phần trăm của dung dịch muối thu được sau phản ứng? c/ Cần dùng bao nhiêu ml dung dịch NaOH 1M để trung hóa hết lượng Hydrochloric acid HCl trên.
\(4.a/n_{Al}=\dfrac{5,4}{27}=0,2mol\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,2 0,3 0,1 0,3
\(V_{H_2}=0,3.24,79=7,437l\\ b/C_{\%H_2SO_4}=\dfrac{0,3.98}{150}\cdot100=19,6\%\\ c/m_{Al_2\left(SO_4\right)_3}=0,1.342=34,2g\)
Đúng 2
Bình luận (0)
\(5.a/n_{MgO}=\dfrac{4}{40}=0,1mol\\ MgO+2HCl\rightarrow MgCl_2+H_2O\)
0,1 0,2 0,1 0,1
\(C_{\%HCl}=\dfrac{0,2.36,5}{200}\cdot100=3,65\%\\ b/C_{\%MgCl_2}=\dfrac{0,1.95}{200+4}\cdot100=4,66\%\\ c/NaOH+HCl\rightarrow NaCl+H_2O\\ n_{NaOH}=n_{HCl}=0,2mol\\ V_{NaOH}=\dfrac{0,2}{1}=0,2l=200ml\)
Đúng 1
Bình luận (0)
Cho 3,68 gam hỗn hợp gồm Al và Zn tác dụng với một lượng vừa đủ dung dịch H2SO4 10%, thu được 2,24 lít khí H2 (đkc). Khối lượng dung dịch thu được sau phản ứng là
A. 101,48 gam
B. 101,68 gam
C. 88,20 gam
D. 97,80 gam.
Theo ĐL bao toàn nguyên tố, số mol H2SO4 tham gia phan ứng là:
n(H2SO4) = n(H2) = 2,24/22,4 = 0,1 mol
→ m(H2SO4) = 0,1.98 = 9,8g
Khối lượng dd H2SO4 đa d ng:
m(dd H2SO4) = m9H2SO4)/C% = 9,8/10% = 98g
Khối lượng dung dich thu được sau pư:
m(dd sau) = m(dd H2SO4) + m(hh KL) - m(H2) = 98 + 3,68 - 0,1.2 = 101,48g
=> Đáp án A
Đúng 0
Bình luận (0)
Cho 5,2 gam hỗn hợp gồm Al, Mg và Zn tác dụng vừa đủ với dung dịch H2SO4 10% thu được dung dịch Y và 3,36 lít khí H2 (đkc). Khối lượng của dung dịch Y là:
A. 152 gam.
B. 146,7 gam.
C. 175,2 gam
D. 151,9 gam.
Cho 5,2 gam hỗn hợp gồm Al, Mg và Zn tác dụng vừa đủ với dung dịch H2SO4 10% thu được dung dịch Y và 3,36 lít khí H2 (đkc). Khối lượng của dung dịch Y là: A. 152 gam. B. 146,7 gam. C. 175,2 gam D. 151,9 gam.
Đọc tiếp
Cho 5,2 gam hỗn hợp gồm Al, Mg và Zn tác dụng vừa đủ với dung dịch H2SO4 10% thu được dung dịch Y và 3,36 lít khí H2 (đkc). Khối lượng của dung dịch Y là:
A. 152 gam.
B. 146,7 gam.
C. 175,2 gam
D. 151,9 gam.
Bài 13: Cho 5,4 gam aluminium (Al) tác dụng với H2SO4
a. Tính thể tích khí H2 sinh ra (đkc )
b. Nếu dùng thể tích khí H2 thu được trên để khử iron (III) oxide (Fe2O3) thì thu được bao nhiêu gam iron (sắt)?
Bài 13:
a) \(n_{H_2}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0,2---------------------------->0,3
=> VH2 = 0,3.24,79 = 7,437 (l)
b)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,3------->0,2
=> mFe = 0,2.56 = 11,2 (g)
Đúng 8
Bình luận (0)
Bài 13: Cho 5,4 gam aluminium (Al) tác dụng với H2SO4
a. Tính thể tích khí H2 sinh ra (đkc )
b. Nếu dùng thể tích khí H2 thu được trên để khử iron (III) oxide (Fe2O3) thì thu được bao nhiêu gam iron (sắt)?
a.\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,2 0,3 ( mol )
\(V_{H_2}=0,3.24,79=7,437l\)
b.\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,3 0,2 ( mol )
\(m_{Fe}=0,2.56=11,2g\)
Đúng 5
Bình luận (1)
tk
Bài 13:
a) nH2=5,4/27=0,2(mol)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0,2---------------------------->0,3
=> VH2 = 0,3.24,79 = 7,437 (l)
b)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,3------->0,2
=> mFe = 0,2.56 = 11,2 (g)
Bài 4: Cho 5,4 gam Aluminium (Al) tác dụng vừa đủ với 150 gam dung dịch Sulfuric acid H2SO4.
a/ Tính thể tích khi Hydrogen (Hz ) sinh ra (ở đkc). b Tính nồng độ phần trăm của dung dịch H2SO4.
c/ Tinh khối lượng muối tạo thành.
Bài 5: Cho 4 gam kim loại Magnesium oxide MgO phản ứng vừa đủ với 200 gam dung dịch Hydrochloric
acid HCI
a Tỉnh nồng độ phần trăm của dung dịch HCl?
b/ Tính nồng độ phần trăm của dung dịch muối thu được sau phản ứng?
c/ Cần dùng bao nhiêu ml dung dịch NaOH IM để tr...
Đọc tiếp
Bài 4: Cho 5,4 gam Aluminium (Al) tác dụng vừa đủ với 150 gam dung dịch Sulfuric acid H2SO4. a/ Tính thể tích khi Hydrogen (Hz ) sinh ra (ở đkc). b Tính nồng độ phần trăm của dung dịch H2SO4. c/ Tinh khối lượng muối tạo thành. Bài 5: Cho 4 gam kim loại Magnesium oxide MgO phản ứng vừa đủ với 200 gam dung dịch Hydrochloric acid HCI a Tỉnh nồng độ phần trăm của dung dịch HCl? b/ Tính nồng độ phần trăm của dung dịch muối thu được sau phản ứng? c/ Cần dùng bao nhiêu ml dung dịch NaOH IM để trung hóa hết lượng Hydrochloric acid HCl trên. Bài 6: Cho 21,4 gam Fe(OH)3 tác dụng vừa đủ với 200 gam dung dịch Hydrochloric acid HCI. a) Tính nồng độ phần trăm của dung dịch HCl? b) Tỉnh nồng độ phần trăm của dung dịch muối thu được sau phản ứng? Bài 7 : Cho m (g) Zinc oxide ZnO tác dụng vừa đủ 100g dung dịch Sulfuric acid H2SO4 9,8%. a) Tính m b) Tính C% dung dịch muối thu được. Bài 8 : Cho m(g) kim loại Aluminium (Al) tác dụng vừa đủ với 300 ml dung dịch Hydrochloric acid HCI thấy thoát ra 7,437 lít khí hydrogen (Hz) ở đkc. a) Tính m b) Tính nồng độ mol dung dịch HCl cần dùng. c) Tính nồng độ mol dung dịch muối thu được. Biết thể tích dung dịch sau phản ứng thay đổi không đáng kể. Bài 9: Cho 8,4 gam hỗn hợp gồm Mg và MgO phản ứng vừa đủ với m gam dung dịch hydrochloric acid (HCI) 3,65%, sau phản ứng thu được 2,479 lít khí hydrogen (Hz) (ở đkc). a) Tính khối lượng mỗi chất trong hỗn hợp ban đầu. b) Tính m
\(4.\\ a/n_{Al}=\dfrac{5,4}{27}=0,2mol\\2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(0,2......0,3............0,1...............0,3\)
\(V_{H_2}=0,3.24,79=7,437l\\ b.C_{\%H_2SO_4}=\dfrac{0,3.98}{150}\cdot100=19,6\%\\ c.m_{Al_2\left(SO_4\right)_3}=0,1.342=34,2g\)
Đúng 3
Bình luận (0)
\(7.\\a) n_{H_2SO_4}=\dfrac{100.9,8}{100.98}=0,1mol\\ ZnO+H_2SO_4\rightarrow ZnSO_4+H_2O\\ n_{ZnO}=n_{ZnSO_4}=n_{H_2SO_4}=0,1mol\\ m_{ZnO}=0,1.81=8,1g\\ b)C_{\%ZnSO_4}=\dfrac{0,1.161}{8,1+100}\cdot100=14,8\%\)
Đúng 3
Bình luận (0)
\(9.\\ a)n_{H_2}=\dfrac{2,479}{24,79}=0,1mol\\ Mg+2HCl\rightarrow MgCl_2+H_2\)
\(0,1.....0,2.........0,1........0,1\)
\(m_{Mg}=0,1.24=2,4g\\ m_{MgO}=8,4-2,4=6g\\ b)n_{MgO}=\dfrac{6}{40}=0,15mol\\ MgO+2HCl\rightarrow MgCl_2+H_2O\\ n_{HCl}=0,15.2+0,2=0,5mol\\ m_{ddHCl}=\dfrac{0,5.36,5}{3,65}\cdot100=500g\)
Đúng 3
Bình luận (7)
Xem thêm câu trả lời
Cho 21,7 gam hỗn hợp gồm Al, Mg, Fe phản ứng với dung dịch H2SO4 loãng dư thì thu được 60,1 gam hỗn hợp muối khan. Thể tích của khí H2 ở đkc thu được là
Cho 5,4 Al tác dụng với H2SO4 thu được 18g AL2SO43 và khí H2 a, tính hiệu suất phản ứng b, tính thể tích khí H2 thực tế thu được ĐKC
a) \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(n_{Al}=\dfrac{5,4}{54}=0,1\left(mol\right)\)
Theo PTHH: \(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,05\left(mol\right)\)
\(\Rightarrow m_{Al_2\left(SO_4\right)_3}=0,05\cdot342=17,1\left(g\right)\)
Hiệu suất phản ứng là:
\(H=\dfrac{17,1}{18}\cdot100\%=95\%\)
b) Theo PTHH: \(n_{H_2}=\dfrac{0,1\cdot3}{2}=0,15\left(mol\right)\)
\(\Rightarrow V_{H_2,dkc}=0,15\cdot24,79=3,7185\left(l\right)\)
Đúng 2
Bình luận (0)