Tính khối lượng H2SO4 có trong 20 gam dung dịch H2SO4 98%.
ML
Những câu hỏi liên quan
Có 100ml dung dịch H2SO4 98%, khối lượng riêng là 1,84 g/ml. Người ta muốn pha loãng thể tích H2SO4 trên thành dung dịch H2SO4 20%.
Tính thể tích nước cần dung để pha loãng.
Thể tích nước cần dùng để pha loãng.
Khối lượng của 100ml dung dịch axit 98%
100ml × 1,84 g/ml = 184g
Khối lượng H2SO4 nguyên chất trong 100ml dung dịch trên: 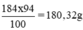
Khối lượng dung dịch axit 20% có chứa 180,32g H2SO4 nguyên chất: 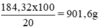
Khối lượng nước cần bổ sung vào 100ml dung dịch H2SO4 98% để có được dung dịch 20%: 901,6g – 184g = 717,6g
Vì D của nước là 1 g/ml nên thể tích nước cần bổ sung là 717,6 ml.
Đúng 1
Bình luận (0)
Hãy tính: a. Số mol của: 24,5 gam H2SO4, 560 ml khí SO2 (đktc). b. Khối lượng của NaOH có trong 150 ml dung dịch NaOH 0,2Mc. Khối lượng của CuSO4 có trong 150 gam dung dịch CuSO4 20%
Đọc tiếp
Hãy tính:
a. Số mol của: 24,5 gam H2SO4, 560 ml khí SO2 (đktc).
b. Khối lượng của NaOH có trong 150 ml dung dịch NaOH 0,2M
c. Khối lượng của CuSO4 có trong 150 gam dung dịch CuSO4 20%
a, \(n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\)
\(n_{SO_2}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\)
b, \(n_{NaOH}=0,15.0,2=0,03\left(mol\right)\Rightarrow m_{NaOH}=0,03.40=1,2\left(g\right)\)
c, \(m_{CuSO_4}=150.20\%=30\left(g\right)\)
Đúng 3
Bình luận (0)
Tính khối lượng H2SO4 có trong 150 gam dung dịch H2SO4 với C%=14%
\(m_{H_2SO_4}=150.14\%=21\left(g\right)\)
Đúng 1
Bình luận (2)
\(m_{H_2SO_4}=150.14\%=21\left(g\right)\)
Đúng 0
Bình luận (0)
Bài 1: Cần thêm bao nhiêu gam SO3 vào dung dịch H2SO4 nồng độ 10% để được 100 gam H2SO4 phải thêm nước vào dung dịch H2SO4 50% để thu được dung dịch H2SO4 20%. Tính tỉ lệ về khối lượng nước và dung dịch axit phải dùng để thu được dung dịch 20%.
Có 100ml dung dịch H2SO4 98%, khối lượng riêng là 1,84 g/ml. Người ta muốn pha loãng thể tích H2SO4 trên thành dung dịch H2SO4 20%.
Khi pha loãng phải tiến hành như thế nào?
Cách tiến hành khi pha loãng
Khi pha loãng lấy 717,6 ml H2O vào ống đong hình trụ có thể tích khoảng 2 lít. Sau đó cho từ từ 100ml H2SO4 98% vào lượng nước trên, đổ axit chảy theo một đũa thủy tinh, sau khi đổ vài giọt nên dùng đũa thủy tinh khuấy nhẹ đều. Không được đổ nước vào axit 98%, axit sẽ bắn vào da, mắt..và gây bỏng rất nặng
Đúng 0
Bình luận (0)
Tính m gam BaCl2.2H2O cần thêm 100ml axit H2SO4 có nồng độ 40% (d=1,3g/ml).Để được dung dịch có phần khối lượng của H2SO4 20%
Cho 2,32 gam Fe3O4 tác dụng vừa đủ với dung dịch H2SO4 20%.
a) Tính khối lượng dung dịch H2SO4 đã dùng
b) Tính nồng độ % của dung dịch thu được sau phản ứng.
Ta có: \(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01\left(mol\right)\)
a. PTHH: Fe3O4 + 4H2SO4 ---> FeSO4 + Fe2(SO4)3 + 4H2O
Theo PT: \(n_{H_2SO_4}=4.n_{Fe_3O_4}=4.0,01=0,04\left(mol\right)\)
=> \(m_{H_2SO_4}=0,04.98=3,92\left(g\right)\)
Theo đề, ta có: \(C_{\%_{H_2SO_4}}=\dfrac{3,92}{m_{dd_{H_2SO_4}}}.100\%=20\%\)
=> \(m_{dd_{H_2SO_4}}=19,6\left(g\right)\)
b. Ta có: \(m_{dd_{SauPỨ}}=2,32+19,6=21,92\left(g\right)\)
Theo PT: \(n_{FeSO_4}=n_{Fe_2\left(SO_4\right)_3}=n_{Fe_3O_4}=0,01\left(mol\right)\)
=> \(m_{FeSO_4}=0,01.152=1,52\left(g\right)\)
\(m_{Fe_2\left(SO_4\right)_3}=0,01.400=4\left(g\right)\)
=> \(m_{SauPỨ}=1,52+4=5,52\left(g\right)\)
=> \(C_{\%_{SauPỨ}}=\dfrac{5,52}{21,92}.100\%=25,18\%\)
Đúng 1
Bình luận (0)
Cho 8,3 gam hỗn hợp gồm Al, Fe có số mol bằng nhau tác dụng với dung dịch H2SO4 thu được dung dịch A và V lit H2.a. Tính khối lượng H2SO4 phản ứng.b. Tính V và tính khối lượng muối trong dung dịch A
Đọc tiếp
Cho 8,3 gam hỗn hợp gồm Al, Fe có số mol bằng nhau tác dụng với dung dịch H2SO4 thu được dung dịch A và V lit H2.
a. Tính khối lượng H2SO4 phản ứng.
b. Tính V và tính khối lượng muối trong dung dịch A
Gọi nAl = nFe = x (mol)
⇒ 27x + 56x = 8,3 ⇒ x = 0,1 (mol)
PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
a, Theo PT: \(n_{H_2SO_4}=\dfrac{3}{2}n_{Al}+n_{Fe}=0,25\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=0,25.98=24,5\left(g\right)\)
b, Theo PT: \(n_{H_2}=n_{H_2SO_4}=0,25\left(mol\right)\) \(\Rightarrow V_{H_2}=0,25.22,4=5,6\left(l\right)\)
\(\left\{{}\begin{matrix}n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,05\left(mol\right)\\n_{FeSO_4}=n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
⇒ m muối = 0,05.342 + 0,1.152 = 32,3 (g)
Đúng 1
Bình luận (0)
hòa tan hoàn toàn 2,04 gam AL2O3 trong dung dịch H2SO4 ( lấy dư 20% so với ban đầu ) ta thu được sản phẩm AL2(SO4)3 và hơi nước
a )Tính khối lượng H2SO4 ban đầu đã dùng
b) tính khối lượng muối sinh ra
Al2O3 + 3H2SO4 -> Al2(SO4)3 + 3H2O
0.02 0.06 0.02
\(nAl2O3=\dfrac{2.04}{102}=0.02mol\)
a.mH2SO4 đã dùng\(=\dfrac{0.06\times98}{20\%}=29.4g\)
b.m muối sinh ra\(=0.02\times342=6.84g\)
Đúng 4
Bình luận (0)





