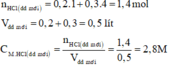tình nồng độ dung dịch khi trộn 200ml dung dịch HCl 0,5M với 600ml dung dịch 1,5M
NN
Những câu hỏi liên quan
Trộn 200ml dung dịch HCl 1M với 300ml dung dịch HCl 0,5M. Tính nồng độ mol của dung dịch HCl sau khi trộn.
\(V_{\text{dd}}=0,2+0,3=0,5\left(l\right)\\ n_{HCl}=0,2.1+0,3.0,5=0,35\\ C_M=\dfrac{0,35}{0,5}=0,7M\)
Đúng 6
Bình luận (0)
200ml = 0,2(l)
=> nHCl (1) = 0,2 .1 = 0,2 (mol)
300ml = 0,3 (l)
=> nHCl(2) = 0,3 . 0,5 = 0,15 (mol)
=> CM (sau khi trộn) = n/V = (0,15+0,2) / (0,2+0,3 ) = 0,35 / 0,5 = 0,7 M
Đúng 4
Bình luận (0)
1/ Cho 200ml dung dịch NaOH 1,5M vào 400ml dung dịch NaOH 0,5M. Hỏi thu được 1 dung dịch mới có nồng độ bao nhiêu
2/ Trộn 300g dung dịch NaCl 3,5% với 200g dung dịch NaCl 2%. Tính nồng độ của dung dịch muối
nNaOH 1,5M=0,2.1,5=0,3(mol)
nNaOH 0,5M=0,4.0,5=0,2(mol)
CM dd NaOH mới=\(\dfrac{0,5}{0,6}=\dfrac{5}{6}M\)
Đúng 0
Bình luận (0)
Đổi: 200ml=0,2l ; 400ml=0,4l
Số mol của dd NAOH 1,5M là:
nNAOH(1)=V1.CM=0,2.1,5=0,3(mol)
Số mol của dd NAOH 0,5M là:
nNAOH(2)=V2.CM=0,4.0,5=0,2(mol)
Tổng số mol NAOH của 2 dd là:
n=nNAOH(1)+nNAOH(2)=0,3+0,2=0,5(mol)
Tổng thể tích của 2 dd là:
V=V1+V2=0,2+0,4=0,6(lít)
Nồng độ của dd mới là:
CM=\(\dfrac{n}{V}\)=\(\dfrac{0,5}{0,6}\)=0,83%
Đúng 0
Bình luận (0)
mNaCl 3,5%=10,5(g)
mNaCl 2%=4(g)
C% dd NaCl=\(\dfrac{14,5}{500}.100\%=2,9\%\)
Đúng 0
Bình luận (0)
Bài 1: Trộn 300ml dung dịch NaOH 1,5M với 400ml dung dịch NaOH 2,5M. Tính nồng độ mol của dung dịch thu được?
Bài 5: Cần lấy bao nhiêu lit dd HCl 0,2M để khi trộn với dd HCl 0,8M thì thu được 2lit dd HCl 0,5M? Giả sử không có sự thay đổi thể tích khi trộn.
B4:
nNaOH = 0,3 . 1,5 + 0,4 . 2,5 = 1,45 (mol)
VddNaOH = 0,3 + 0,4 = 0,7 (l)
CMddNaOH = 1,45/0,7 = 2,07M
B5:
nHCl (sau khi pha) = 0,5 . 2 = 1 (mol)
Gọi VHCl (0,2) = x (l); VHCl (0,8) = y (l)
x + y = 2 (1)
nHCl (0,2) = 0,2x (mol)
nHCl (0,8) = 0,8y (mol)
=> 0,2x + 0,8y = 1 (2)
(1)(2) => x = y = 1 (l)
Đúng 1
Bình luận (0)
1/ Trộn 200ml dung dịch NaOH 0,4M với 400ml dung dịch HCl 0,3M. Tính nồng độ mol/ lít của các ion có trong dung dịch thu đc
2/ Trộn 200ml dung dịch KCl 1,5M với 300ml dung dịch K2SO4 2M. Tính nồng độ mol/ lít của các ion có trong dung dịch thu đc
Bài 1:
Ta có: \(n_{OH^-}=n_{Na^+}=n_{NaOH}=0,2.0,4=0,08\left(mol\right)\)
\(n_{H^+}=n_{Cl^-}=n_{HCl}=0,4.0,3=0,12\left(mol\right)\)
PT ion: \(OH^-+H^+\rightarrow H_2O\)
_____0,08_____0,12 (mol)
⇒ nOH- (dư) = 0,04 (mol)
\(\Rightarrow\left\{{}\begin{matrix}\left[Na^+\right]=\frac{0,08}{0,6}\approx0,133M\\\left[Cl^-\right]=\frac{0,12}{0,6}=0,2M\\\left[OH^-\right]=\frac{0,04}{0,6}\approx0,066M\end{matrix}\right.\)
Câu 2:
Ta có: \(\Sigma n_{K^+}=n_{KCl}+2n_{K_2SO_4}=0,2.1,5+0,3.2.2=1,5\left(mol\right)\)
\(n_{Cl^-}=n_{KCl}=0,2.1,5=0,3\left(mol\right)\)
\(n_{SO_4^{2-}}=0,3.2=0,6\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\left[K^+\right]=\frac{1,5}{0,5}=3M\\\left[Cl^-\right]=\frac{0,3}{0,5}=0,6M\\\left[SO_4^{2-}\right]=\frac{0,6}{0,5}=1,2M\end{matrix}\right.\)
Bạn tham khảo nhé!
Khi trộn 200ml dung dịch HCl 1M với 300ml dung dịch HCl 4M thì thu được dung dịch mới có nồng độ là
A. 2M
B. 2,5M
C. 2,8M
D. 3,0M
Trộn 50ml dung dịch Ba(OH)2 0,5M với 150ml dung dịch HCl 0,1M thu được 200ml dung dịch A. Xác định CM ( nồng độ mol) các chất trong dung dịch A
help me..Ba(OH)2 + 2HCl → BaCl2 + 2H2O
\(n_{Ba\left(OH\right)_2}=0,05\times0,5=0,025\left(mol\right)\)
\(n_{HCl}=0,15\times0,1=0,015\left(mol\right)\)
Theo PT: \(n_{Ba\left(OH\right)_2}=\dfrac{1}{2}n_{HCl}\)
Theo bài: \(n_{Ba\left(OH\right)_2}=\dfrac{5}{3}n_{HCl}\)
Vì \(\dfrac{5}{3}>\dfrac{1}{2}\) ⇒ \(Ba\left(OH\right)_2\) dư
Dung dịch A gồm: Ba(OH)2 dư và BaCl2
Theo PT: \(n_{Ba\left(OH\right)_2}pư=\dfrac{1}{2}n_{HCl}=\dfrac{1}{2}\times0,015=0,0075\left(mol\right)\)
\(\Rightarrow n_{Ba\left(OH\right)_2}dư=0,025-0,0075=0,0175\left(mol\right)\)
\(\Rightarrow C_{M_{Ba\left(OH\right)_2}}dư=\dfrac{0,0175}{0,2}=0,0875\left(M\right)\)
Theo PT: \(n_{BaCl_2}=\dfrac{1}{2}n_{HCl}=\dfrac{1}{2}\times0,015=0,0075\left(mol\right)\)
\(\Rightarrow C_{M_{BaCl_2}}=\dfrac{0,0075}{0,2}=0,0375\left(M\right)\)
Đúng 0
Bình luận (0)
tìm nồng độ mol/l của các ion trong dung dịch thu được khi
a, trộn 300ml dung dịch \(CuCl_2\) 1M vào 200ml dung dịch \(BaCl_2\) 0,5M
b, trộn 200ml dung dịch NaCl 1M vào 300ml dung dịch HCl 1M
a) Ta có: \(\left\{{}\begin{matrix}n_{CuCl_2}=0,3\left(mol\right)\\n_{BaCl_2}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left[Cu\right]=\dfrac{0,3}{0,5}=0,6\left(M\right)\\ \Rightarrow\left[Ba\right]=\dfrac{0,1}{0,5}=0,2\left(M\right)\\ \Rightarrow\left[Cl\right]=\dfrac{0,3.2+0,1.2}{0,5}=1,6\left(M\right)\)
Đúng 0
Bình luận (0)
Trung hoà 300ml dung dịch NaOH 1,5M cần dùng 200ml dung dịch chứa HCl xM và \(H_2SO_4\) 0,5M , thu được dung dịch X. Tính nồng độ mol các ion trong X.
\(n_{OH^-}=n_{NaOH}=0,3.1,5=0,45\left(mol\right)\\ n_{H^+}=n_{HCl}+2n_{H_2SO_4}=0,2x+0,5.0,2.2=0,2x+0,2\left(mol\right)\)
PT ion rút gọn: \(H^++OH^-\rightarrow H_2O\)
0,45<---0,45
\(\Rightarrow0,2x+0,2=0,45\Leftrightarrow x=1,25M\)
Ta có: \(V_{dd}=0,3+0,2=0,5\left(l\right)\) và \(\left\{{}\begin{matrix}n_{Na^+}=0,45\left(mol\right)\\n_{Cl^-}=0,2.1,25=0,25\left(mol\right)\\n_{SO_4^{2-}}=0,2.0,5=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}C_{Na^+}=\dfrac{0,45}{0,5}=0,9M\\C_{Cl^-}=\dfrac{0,25}{0,5}=0,5M\\C_{SO_4^{2-}}=\dfrac{0,1}{0,5}=0,2M\end{matrix}\right.\)
Đúng 2
Bình luận (0)
trộn 2 lít dung dịch KOH 0,5M với 3 lít dung dịch KOH 1M, nồng độ mol của dung dịch KOH sau khi trộn là
A: 1,5M
B:0,8M
C:0,75M
D:0,5M
B nha bạn
cách làm
trộn 2 lít dung dịch KOH 0,5M với 3 lít dung dịch KOH 1M, nồng độ mol của dung dịch KOH sau khi trộn là
A: 1,5M
B:0,8M
C:0,75M
D:0,5M
Hình như là 0,8M á