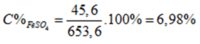a.53,6 x 21 + 53,6 +78 x 53,6 b. 4,5 x 23,6 – 23,5 x 4,5
X là chất phóng xạ β - . Ban đầu có một mẫu A nguyên chất. Sau 53,6 phút, số hạt β - sinh ra gấp 3 lần số hạt nhân X còn lại trong mẫu. Chu kì bán rã của X bằng
A. 8,93 phút
B. 53,6 phút
C. 13,4 phút
D. 26,8 phút
X là chất phóng xạ β - . Ban đầu có một mẫu A nguyên chất. Sau 53,6 phút, số hạt β - sinh ra gấp 3 lần số hạt nhân X còn lại trong mẫu. Chu kì bán rã của X bằng
A. 8,93 phút.
B. 53,6 phút.
C. 13,4 phút.
D. 26,8 phút.
Chọn D
Ta có:
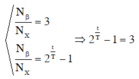
⇒ 2 t T = 2 2 ⇒ t T = 2 ⇒ T = t 2 = 26 , 8 p h ú t
Bài 4: Tính nhanh: 53,6 : 0,125 : 8
Đáp án:
268
Giải thích các bước giải:
53,6:0,125 x 5 : 8
= 53,6 x 5 : ( 0,125 x 8 )
=53,6 x 5 : 1
=268
Một khoáng vật chứa 31,3% Si, 53,6% O còn lại là Al và Be. Xác định công thức khoáng vật
% Al và Be còn lại: 15.1%
Gọi % Be = a
-> %Al = 15.1 - a
Do hóa trị của Al = 3, Be = 2, Si = 4 và O = 2 nên ta có:
[(15.1 - a) / 27] . 3 + [(a / 9) . 2] + [(31.3 / 28) . 4] -- [(53.6 / 16) . 2] = 0
Giải PT cho a = 4.96 và 15.1 - a = 10.14
Đặt CT giả thiết cho là AlxBeSizOt ta có:
x : y : z : t = (10.14 / 27) : (4.96 / 9) : (31.3 / 28) : (53.6 / 16)
<-> 2 : 3 : 6 : 18
-> Công thức khoáng chất là Al2 Be3 Si6 O18 hay Al2O3. 3BeO. 6SiO2
% Al và Be còn lại là: 15.1%
Gọi % Be = a
\(\rightarrow\) %Al = 15.1 - a
Do hóa trị của Al = 3, Be = 2, Si = 4 và O = 2 nên ta có:
\(\dfrac{15,1-a}{27}.3+\dfrac{a}{9}.2+\dfrac{31.3}{28}.4-\dfrac{53.6}{16}.2=0\)
Giải PT cho a = 4.96 và 15.1 - a = 10.14
Đặt CT giả thiết cho là AlxBeySizOt ta có:
x : y : z : t = \(\dfrac{14.10}{27}:\dfrac{4.96}{9}:\dfrac{31.3}{28}:\dfrac{53.6}{16}\)
\(\Leftrightarrow\)2 : 3 : 6 : 18
-> Công thức khoáng chất là Al2Be3Si6O18 hay Al2O3.3BeO.6SiO2
Gọi cthh của khoáng vật là: SixOyAlzBet (x, y, z, t > 0).
Ta có: %mSi + %mO + %mAl + %mBe = 100%
31,3%mSi + 53,6%mO + %mAl + %mBe = 100%
%mAl + %mBe = 100% - 31,3% - 53,6%
%mAl + %mBe = 15,1%
Gọi số %mAl là a% ---> %mBe = 15,1 - a
x : y : z : t = \(\dfrac{31,3}{28}\) : \(\dfrac{53,6}{16}\) : \(\dfrac{a}{27}\) : \(\dfrac{15,1-a}{9}\) (1)
x : y : z : t = 1,117 : 3,35 : \(\dfrac{a}{27}\) : \(\dfrac{15,1-a}{9}\)
=> CTHH của khoáng chất là: Si1,117O3,35Al\(\dfrac{a}{27}\)Be\(\dfrac{15,1-a}{9}\)
Biết Si hóa trị IV, O hóa trị II, Al hóa trị III, Be hóa trị II. Áp dụng quy tắc hóa trị, ta có:
IV.1,117 + III.\(\dfrac{a}{27}\) + II.\(\dfrac{15,1-a}{9}\) = II.3,35
4,468 + \(\dfrac{a}{9}\) + \(\dfrac{30,2-2a}{9}\) = 6,7
40,212 + a + 30,2 - 2a = 60,3
a - 2a = 60,3 - 40,212 - 30,2
-a = -10,112
a = 10,112
Thay a = 10,112 vào (1) ta có:
x : y : z : t = 1,117 : 3,35 : 0,374 : 0,554
x : y : z : t = 3 : 9 : 1 : 1,5
x : y : z : t = 6 : 18 : 2 : 3
=> CTHH của khoáng vật là: Si6O18Al2Be3.
=> Al2O3 . 3BeO . SiO2.
Tính bằng cách thuận tiện nhất: 15,127 × 53,6 + 15,127 × 47,4 - 15,127
\(=15,127\times\left(53,6+47,4-1\right)=15,127\times100=1512,7\)
15,127 × 53,6 + 15,127 × 47,4 - 15,127
= 15.127 x (53.6 + 47.4 - 1)
=15.127 x 100 = 1512.7
Các bạn chỉ mình có phải độ tan của 1 chát là số gam chatas đó tan trong 100 g nước tạo thành dung dịch bão hòa :
+ Dung dịch bão hòa ở ddaay cũng là 100 g dung dịch bảo hòa ạ
+ Ví dụ : 53,6 gam MgCl2 tan tối đa trong 100 gam nước thành 100 + 53,6 = 153,6 gam dung dịch bão hòa
Vậy phải rút con số 153,6 lại thành 100 g dung dịch ạ hay là như thế nào ạ
Các bạn chỉ mình có phải độ tan của 1 chát là số gam chatas đó tan trong 100 g nước tạo thành dung dịch bão hòa :
+ Dung dịch bão hòa ở ddaay cũng là 100 g dung dịch bảo hòa ạ
+ Ví dụ : 53,6 gam MgCl2 tan tối đa trong 100 gam nước thành 100 + 53,6 = 153,6 gam dung dịch bão hòa
Vậy phải rút con số 153,6 lại thành 100 g dung dịch ạ hay là như thế nào ạ
Đúng rồi em
Em dùng quy tắc tam suất nha!
100 gam dung dịch MgCl2 bão hòa biết độ tan của MgCl2 là 53,6 gam
\(S=\dfrac{m_{ct}}{m_{dd}}.100\)
=> \(53,6=\dfrac{m_{MgCl_2}}{100}.100\)
=> m MgCl2 = 53,6g
Độ tan của $MgCl_2$ là 53,6 gam tức là :
53,6 gam $MgCl_2$ tan tối đa trong 100 gam nước tạo thành 153,6 gam dung dịch bão hòa
$\Rightarrow m_{MgCl_2} = \dfrac{100.53,6}{153,6} = 34,9(gam)$
Hòa tan hoàn toàn 53,6 gam hỗn hợp A gồm (FeO, CuO) cần dùng vừa đủ 500 ml dung dịch H 2 S O 4 1,4M (D = 1,2g/ml) thu được dung dịch X. Giả thiết thể tích của dung dịch sau phản ứng thay đổi không đáng kể. Nồng độ phần trăm của muối F e S O 4 trong dung dịch X là
A. 7,04%
B. 6,06%
C. 9,30%
D. 6,98%
Chọn D
Gọi số mol của FeO và CuO lần lượt là x và y mol
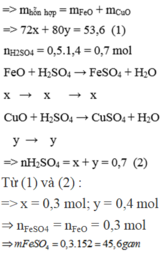
Ta có: m d d H 2 S O 4 = D . V = 1 , 2 . 500 = 600 g a m
Vì phản ứng không tạo ra chất khí hay kết tủa nên:
m d d s a u p ư = m t r ư ớ c p ư = m h h A + m d d a x i t = 53 , 6 + 600 = 653 , 6 g a m .