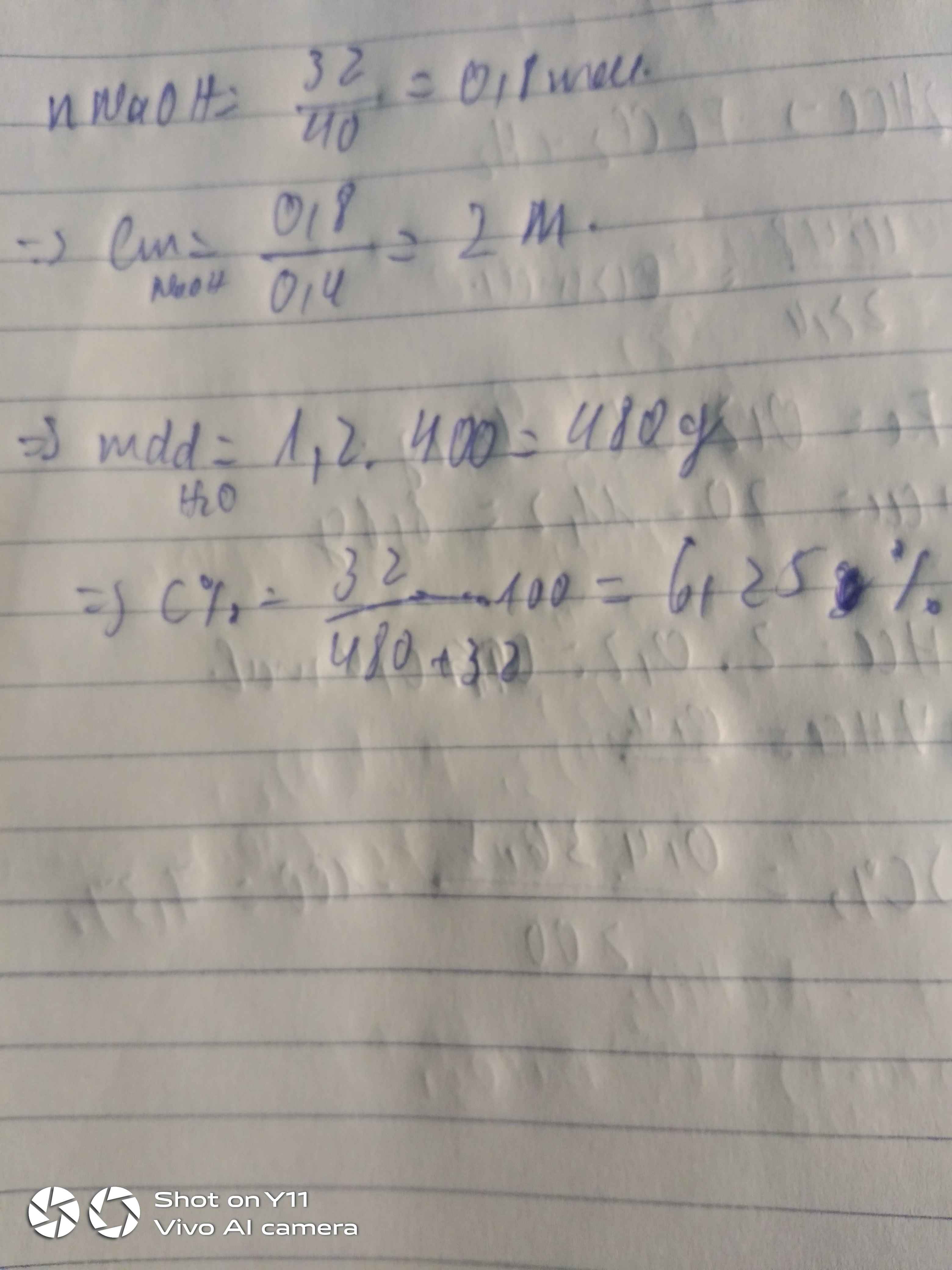Trong 400ml dung dịch có chứa 32g CuSO4. Nồng độ MOL của dung dịch đó là
TV
Những câu hỏi liên quan
Trong 400ml dung dịch có chứa 19,6g H2SO4. Nồng độ MOL của dung dịch đó là
Ta có: \(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\) \(\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,2}{0,4}=0,5\left(M\right)\)
Đúng 1
Bình luận (0)
Trong 400 ml dung dịch có hòa tan 32g CuSo4. Tính nồng độ mol của dung dịch
Trong 400ml dung dịch có hòa tan 16g CuSO4.Tính nồng độ mol của dung dịch
\(n_{CuSO_4}=\dfrac{16}{160}=0,1\left(mol\right)\)
\(\Rightarrow C_{M_{CuSO_4}}=\dfrac{0,1}{0,4}=0,25\left(M\right)\)
Đúng 1
Bình luận (0)
Cho dung dịch CuSO4 có chứa 64g CuSO4 phản ứng vừa đủ với 400ml dung dịch NaOH a.Viết phương trình hoá học xảy ra b.Tính khối lượng kết tủa thu được c.tính nồng độ mol của dung dịch NaOH
a) $CuSO_4 + 2NaOH \to Cu(OH)_2 + Na_2SO_4$
b) Theo PTHH : $n_{Cu(OH)_2} = n_{CuSO_4} = \dfrac{64}{160} = 0,4(mol)$
$m_{Cu(OH)_2} = 0,4.98 = 39,2(gam)$
c) $n_{NaOH} = 2n_{CuSO_4} = 0,8(mol)$
$C_{M_{NaOH}} = \dfrac{0,8}{0,4} = 2M$
Đúng 2
Bình luận (0)
a) Nồng độ phần trăm của dung dịch có chứa 15gam NaCl trong 60gam dung dịch.
b) Nồng độ mol của dung dịch có chứa 0,1 mol CuSO4 .trong 0,2 lít dung dịch.
\(a,C\%=\dfrac{15}{60}.100=25\%\)
\(b,CM=\dfrac{0,1}{0,2}=0,5M\)
Đúng 1
Bình luận (0)
I. Trắc nghiệm
Nồng độ mol của dung dịch có chứa 50 gam CaBr 2 trong 400ml dung dịch là:
A. 0,625M
B. 0,15M
C. 0,45M
D. 1,25M
Trong 250ml dung dịch có hòa tan 32g CuSO4. Tính nồng độ mol?
\(n_{CuSO_4}=\dfrac{32}{160}=0,2\left(mol\right)\)
=> \(C_M=\dfrac{0,2}{0,25}=0,8M\)
Đúng 7
Bình luận (0)
\(n_{CuSO_4}=\dfrac{32}{160}=0,2mol\)
250ml = 0,25l
\(C_{M_{CuSO_4}}=\dfrac{0,2}{0,25}=0,8M\)
Đúng 5
Bình luận (0)
`n_[CuSO_4] = 32 / 160 = 0,2 (mol)`
`C_[M_[CuSO_4]] = [ 0,2 ] / [ 0,25 ] = 0,8 (M)`
Đúng 5
Bình luận (0)
Trong 500 ml của dung dịch có chứa 32g CuSO4
a)Tính nồng độ mol của dung dịch.
b)Phỉa cần bao nhiêu ml nước vào 100 mol này để được dung dịch CuSO4. 0,2M
HELP ME !!!!!
Cho 32g NaOH vào nước được 400ml dd có khối lượng riêng D=1,2g/ml . Tính nồng độ mol và nồng độ phần trăm của dung dịch