So sánh nhiệt độ sôi và khả năng hòa tan trong nước giữa NH3 và CH4. Giải thích.
H24
Những câu hỏi liên quan
Hòa tan 5g đường saccarozơ vào 200g nước, xác định nhiệt độ sôi và nhiệt độ đông đặc của dung dịch thu được. Hãy giải thích tại sao có sự sai lệch nhiệt độ của dung dịch đường so với nước nguyên chất. Biết nước có hằng số nghiệm sôi và hằng số nghiêm đông lần lượt là 0,52 và 1,86; C=12, H=1,0=16.
Từ thông tin Bảng 16.2 và Hình 16.4, cho biết khả năng hoà tan trong nước của alcohol. Độ tan và nhiệt độ sôi của alcohol thay đổi thế nào theo chiều tăng của khối lượng phân tử?
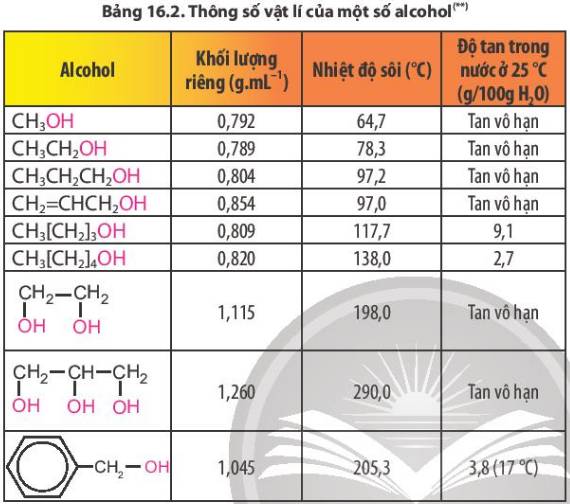
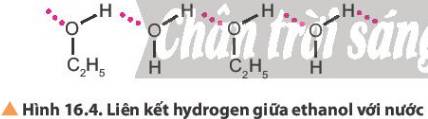
-> Hầu như các alcohol tan vô hạn trong nước.
-> Số lượng C tăng, thì độ tan và nhiệt độ sôi giảm dần.
Đúng 0
Bình luận (0)
Do tạo được liên kết hydrogen với nước nên các alcohol có phân tử khối nhỏ tan tốt trong nước, độ tan giảm khi số nguyên tử carbon tăng
Đúng 0
Bình luận (0)
So sánh nhiệt độ sôi của butanoic acid với nhiệt độ sôi của các chất trong bảng sau. Giải thích.
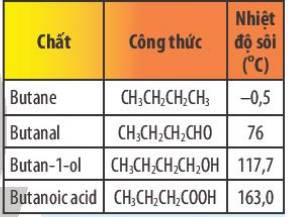
Nhiệt độ sôi: butanoic acid > butan – 1 – ol > butanal > butane.
Giải thích:
+ Vì Butanoic acid có nhiệt độ sôi cao nhất trong dãy do butanoic acid có khả năng tạo thành liên kết hydrogen bền vững hơn liên kết hydrogen trong phân tử butan – 1 – ol.
+ Butanal và butane không có liên kết hydrogen nhưng butanal phân cực nên có nhiệt độ sôi cao hơn butane.
Đúng 0
Bình luận (0)
Cho các chất sau: (1) C3H8, (2) C2H5OH, (3) CH3CHO. Sắp xếp các chất theo chiều tăng dần nhiệt độ sôi và độ tan trong nước. Giải thích.
Tham khảo:
- Chiều tăng dần nhiệt độ sôi: (1) C3H8, (3) CH3CHO, (2) C2H5OH.
Giải thích:
+ C2H5OH có nhiệt độ sôi cao nhất do có khả năng tạo liên kết hydrogen liên phân tử;
+ C3H8 có nhiệt độ sôi thấp nhất do phân tử không phân cực.
+ CH3CHO có nhiệt độ sôi cao hơn C3H8 do phân tử phân cực hơn.
- Độ tan trong nước: (1) C3H8, (3) CH3CHO, (2) C2H5OH.
+ CH3CHO; C2H5OH: tan vô hạn trong nước; ngoài ra C2H5OH tạo được liên kết hydrogen với nước.
+ C3H8: không tan trong nước.
Đúng 1
Bình luận (0)
- Chiều tăng dần nhiệt độ sôi: (1) , (3), (2)
Giải thích:
+ C2H5OH có nhiệt độ sôi cao nhất do có khả năng tạo liên kết hydrogen liên phân tử;
+ C3H8 có nhiệt độ sôi thấp nhất do phân tử không phân cực.
+ CH3CHO có nhiệt độ sôi cao hơn C3H8 do phân tử phân cực hơn.
- Độ tan trong nước: (1),(3) ,(2)
+ CH3CHO; C2H5OH: tan vô hạn trong nước; ngoài ra alcohol ethylic tạo được liên kết hydrogen với nước.
+ C3H8: không tan trong nước.
Đúng 0
Bình luận (0)
Hãy so sánh nhiệt độ sôi của benzene, toluene, o – xylene (Bảng 17.1) và giải thích.
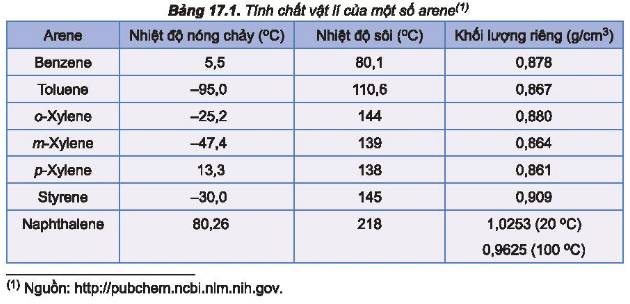
\(M_{benzen}< M_{toulen}< M_{o-xylen}\)
nên nhiệt độ sôi của benzen, toulen, o-xylen tăng dần
Đúng 0
Bình luận (0)
Dựa vào sơ đồ chưng cất dầu mỏ (tr. 127 SGK), hãy so sánh nhiệt độ sôi, khả năng bay hơi, phân tử khối của các chất có trong xăng với các chất có trong dầu hoả và các chất có trong dầu nhờn.
- Nhiệt độ sôi của các chất:
trong dầu nhờn > trong dầu hoả > trong xăng.
- Khả năng bay hơi của các chất :
trong xăng > trong dầu hoả > trong dầu nhờn.
- Phân tử khối của các chất:
trong dầu nhờn > trong dầu hoả > trong xăng.
Đúng 0
Bình luận (0)
Các hợp chất propane, dimethyl ether và ethanol có phân tử khối tương đương nhau và có một số tính chất như sau:
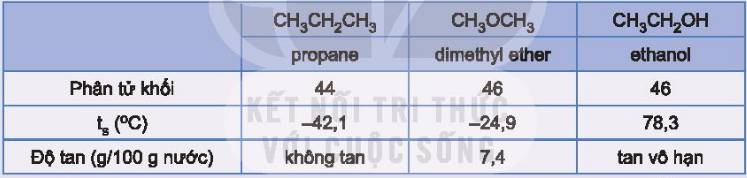
Hãy giải thích tại sao ethanol có nhiệt độ sôi cao hơn và tan trong nước tốt hơn so với hai chất còn lại.
Do các phân tử ethanol có thể tạo liên kết hydrogen với nhau và với nước.
Đúng 0
Bình luận (0)
Trong hai chất nh3 và H2S hãy cho biết chất nào có nhiệt độ sôi cao hơn. Hãy giải thích tại sao
Khả năng hòa tan của các chất và ảnh hưởng của nhiệt độ tới sự hòa tan các chất. Lấy ví dụ?





