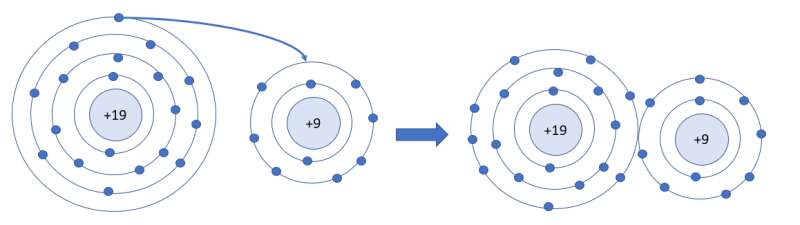
Cho biết đặc điểm của nguyên tử “cho” và nguyên tử “nhận” trong phân tử có liên kết cho – nhận.
H24
Những câu hỏi liên quan
Một nguyên tử X của một nguyên tố có điện tích của hạt nhân là 27,2.
10
-
19
Culông. Cho các nhận định sau về X: (1) Ion tương ứng của X sẽ có cấu hình electron là:
1
s
2
2
s
2
2
p
6
3
s
2
3
p
6...
Đọc tiếp
Một nguyên tử X của một nguyên tố có điện tích của hạt nhân là 27,2. 10 - 19 Culông. Cho các nhận định sau về X:
(1) Ion tương ứng của X sẽ có cấu hình electron là: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6
(2) X là nguyên tử phi kim
(3) Phân tử đơn chất tạo nên từ X chỉ có tính oxi hóa.
(4) Liên kết hóa học giữa các nguyên tử X trong phân tử kém bền hơn liên kết hóa học giữa các nguyên tử N trong phân tử N2.
Có bao nhiêu nhận định đúng trong các nhận định cho ở trên?
A. 1.
B. 2.
C. 3.
D. 4.
Các phát biểu đúng: (1), (2), (4)
Chọn đáp án C
Đúng 0
Bình luận (0)
Một nguyên tử X của một nguyên tố có điện tích của hạt nhân là
27
,
2
.
10
-
19
Culông. Cho các nhận định sau về X:(1) Ion tương ứng của X sẽ có cấu hình electron là:
1
s
2
2
s
2
2
p
6
3
s
2
3
p...
Đọc tiếp
Một nguyên tử X của một nguyên tố có điện tích của hạt nhân là 27 , 2 . 10 - 19 Culông. Cho các nhận định sau về X:
(1) Ion tương ứng của X sẽ có cấu hình electron là: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6
(2) X là nguyên tử phi kim
(3) Phân tử đơn chất tạo nên từ X chỉ có tính oxi hóa.
(4) Liên kết hóa học giữa các nguyên tử X trong phân tử kém bền hơn liên kết hóa học giữa các nguyên tử N trong phân tử N2.
Có bao nhiêu nhận định đúng trong các nhận định cho ở trên?
A. 1.
B. 2.
C. 3.
D. 4.
Một nguyên tử X của một nguyên tố có điện tích của hạt nhân là 27,2.10-19 Culông. Cho các nhận định sau về X : (1) Ion tương ứng của X sẽ có cấu hình electron là : 1s22s22p63s23p6. (2) X là nguyên tử phi kim (3) Phân tử đơn chất tạo nên từ X chỉ có tính oxi hóa. (4) Liên kết hóa học giữa các nguyên tử X trong phân tử kém bền hơn liên kết hóa học giữa các nguyên tử N trong phân tử N2. Có bao nhiêu nhận định đúng trong các nhận định cho ở trên ? A....
Đọc tiếp
Một nguyên tử X của một nguyên tố có điện tích của hạt nhân là 27,2.10-19 Culông. Cho các nhận định sau về X :
(1) Ion tương ứng của X sẽ có cấu hình electron là : 1s22s22p63s23p6.
(2) X là nguyên tử phi kim
(3) Phân tử đơn chất tạo nên từ X chỉ có tính oxi hóa.
(4) Liên kết hóa học giữa các nguyên tử X trong phân tử kém bền hơn liên kết hóa học giữa các nguyên tử N trong phân tử N2.
Có bao nhiêu nhận định đúng trong các nhận định cho ở trên ?
A. 1
B. 2
C. 3
D. 4
Đáp án C
Điện tích hạt nhân X = Số p.(điện tích cơ bản) => số p = 17
=> cấu hình e : 1s22s22p63s23p5 (Clo)
=> Cl- có cấu hình e : 1s22s22p63s23p6
Chỉ có nhận định (3) sai. Cl2 vùa có tính khử , vừa có tính oxi hóa
=>C
Đúng 0
Bình luận (0)
Số electron ở lớp ngoài cùng của nguyên tử K và F lần lượt là 1 và 7. Hãy cho biết khi K hết hợp với F để tạo thành phân tử potassium fluoride, nguyên tử K cho hay nhận bao nhiêu electron. Vẽ sơ đồ tạo thành liên kết trong phân tử potassium fluoride
câu 1: Cho nguyên tử Silic có số P14 và nguyên tử cacbon có số P6 a.Hãy vẽ sơ đồ cấu tạo nguyên tử của hai nguyên tử. b. Cho biết điểm giống và khác nhau của hai nguyên tử trên Câu 2: Mỗi hợp chất có phân tử gồm hai nguyên tử X liên kết với 5 nguyên tử Oxy và nặng hơn nguyên tử Flo là 4 lần a. Xác định phân tử khối của hợp chất b. Xác định nguyên tử khối của Z. Cho biết Z là nguyên tố nào. Viết kí hiệu hóa học. Câu 3: a. Tính hóa trị Cu trong hợp chất CuO b. Lập công thức hóa học của hợp chất tạ...
Đọc tiếp
câu 1: Cho nguyên tử Silic có số P=14 và nguyên tử cacbon có số P=6 a.Hãy vẽ sơ đồ cấu tạo nguyên tử của hai nguyên tử. b. Cho biết điểm giống và khác nhau của hai nguyên tử trên Câu 2: Mỗi hợp chất có phân tử gồm hai nguyên tử X liên kết với 5 nguyên tử Oxy và nặng hơn nguyên tử Flo là 4 lần a. Xác định phân tử khối của hợp chất b. Xác định nguyên tử khối của Z. Cho biết Z là nguyên tố nào. Viết kí hiệu hóa học. Câu 3: a. Tính hóa trị Cu trong hợp chất CuO b. Lập công thức hóa học của hợp chất tạo bởi Fe có hóa trị III và SO4 có hóa trị II c. Cho biết ý nghĩa công thức hóa học hợp chất mới lập được ( cho Fe=56, S=32, Cu=64, Na= 23) Câu 4: Nguyên tử D có tổng số các hạt là 40 trong đó số hạt mang điện chiếm 35%. Tính số hạt mỗi loại
giúp dùm mình nha, cần gấp. thanks nhìucâu 1a/ một hợp chất có phân tử gồm 2 nguyên tử tố X liên kết với 1 nguyên tử O và nặng hơn phân tử Hidro 31 lần- Tính phân tử khối của hợp chất.- Tính nguyên tử khối của X, cho biết tên và kí hiệu của nguyên tố.b/ phân tử 1 hợp chất gồm nguyên tử nguyên tố X liên kết với 4 nguyên tử H và nặng bằng nguyên tử O - Tính nguyên tử khối, cho biết tên và kí hiệu của X.- Tính phần trăm về khối lượng của nguyên tố X trong hợp chất.c/ Phân tử 1 hợp chất gồm nguyên...
Đọc tiếp
giúp dùm mình nha, cần gấp. thanks nhìu
câu 1
a/ một hợp chất có phân tử gồm 2 nguyên tử tố X liên kết với 1 nguyên tử O và nặng hơn phân tử Hidro 31 lần
- Tính phân tử khối của hợp chất.
- Tính nguyên tử khối của X, cho biết tên và kí hiệu của nguyên tố.
b/ phân tử 1 hợp chất gồm nguyên tử nguyên tố X liên kết với 4 nguyên tử H và nặng bằng nguyên tử O
- Tính nguyên tử khối, cho biết tên và kí hiệu của X.
- Tính phần trăm về khối lượng của nguyên tố X trong hợp chất.
c/ Phân tử 1 hợp chất gồm nguyên tử nguyên tố Y liên kết với hai nguyên tử O. Nguyên tố oxi chiếm 50% về khối lượng của hợp chất.
- Tính nguyên tử khối, cho biết tên và kí hiệu hóa học của nguyên tố Y.
- Tính phân tử khối của hợp chất. Phân tử hợp chất nặng bằng nguyên tử nguyên tố nào?
Ta có :
NTK2O = 16 * 2 = 32 (đvC)
=> NGUYÊN TỬ KHỐI của hợp chất trên là :
32 : 50% = 64 (đvC)
Do trong hợp chất trên gồm nguyên tử Y liên kết với 2 nguyên tử Oxi
=> NTKhợp chất = NTKY + NTK2O
=> 64 đvC = NTKY + 32 đvC
=> NTKY = 32 đvC
=> Y là nguyên tố Lưu huỳnh ( S )
Đúng 1
Bình luận (0)
Tính phân tử khối của hợp chất, tính nguyên tử khối của nguyên tố trong hợp chất, cho biết tên, kí hiệu và tính hóa trị của nguyên tố đó.1.Một hợp chất có phân tử gồm 2 nguyên tử nguyên tố X liên kết với 3 nguyên tử nguyên tố oxi và nặng hơn phân tử hiđro 51 lần.a. Tính phân tử khối của hợp chất.b. Tính nguyên tử khối của nguyên tố X, cho biết tên và kí hiệu hóa học của nguyên tố X2. Một hợp chất có phân tử gồm 2 nguyên tử nguyên tố R liên kết với 5 nguyên tử nguyên tố oxi và nặng hơn phân tử ox...
Đọc tiếp
Tính phân tử khối của hợp chất, tính nguyên tử khối của nguyên tố trong hợp chất, cho biết tên, kí hiệu và tính hóa trị của nguyên tố đó.
1.
Một hợp chất có phân tử gồm 2 nguyên tử nguyên tố X liên kết với 3 nguyên tử nguyên tố oxi và nặng hơn phân tử hiđro 51 lần.
a. Tính phân tử khối của hợp chất.
b. Tính nguyên tử khối của nguyên tố X, cho biết tên và kí hiệu hóa học của nguyên tố X
2. Một hợp chất có phân tử gồm 2 nguyên tử nguyên tố R liên kết với 5 nguyên tử nguyên tố oxi và nặng hơn phân tử oxi 4,4375 lần.
a. Tính phân tử khối của hợp chất.
b. Tính nguyên tử khối của nguyên tố R, cho biết tên và kí hiệu hóa học của nguyên tố R.
c. Tính hóa trị của R trong hợp chất trên.
3. Một hợp chất có phân tử gồm 2 nguyên tử nguyên tố R liên kết với 3 nguyên tử nguyên tố oxi và nặng hơn nguyên tử magie 4,25 lần.
a. Tính phân tử khối của hợp chất.
b. Tính nguyên tử khối của nguyên tố R, cho biết tên và kí hiệu hóa học của nguyên tố R.
c. Tính hóa trị của R trong hợp chất trên.
Viết quá trình cho hoặc nhận electron của các nguyên tử sau: Na, Mg, K, Ca, Al, F, Cl, O, N, S.
- Hãy mô tả sự hình thành liên kết ion từ các nguyên tử tương ứng trong các hợp chất sau: NaF,
Na2O, MgO, MgF2.
- Các hợp chất ion có các đặc điểm gì?
1/ Quá trình nhường - nhận electron.
\(Na^0\rightarrow Na^++e\)
\(Mg^0\rightarrow Mg^{2+}+2e\)
\(Ca^0\rightarrow Ca^{2+}+2e\)
\(F^0+e\rightarrow F^-\)
\(Cl^0+e\rightarrow Cl^-\)
\(O^0+2e\rightarrow O^{2-}\)
\(N^0+3e\rightarrow N^{3-}\)
\(S^0+2e\rightarrow S^{2-}\)
2/ Sự hình thành liên kết ion.
- Trong NaF:
+ Nguyên tử Na nhường 1e.
+ Nguyên tử F nhận 1e.
+ Nguyên tử Na và F tích điện trái dấu nên chúng hút nhau tạo thành phân tử NaF.
- Na2O, MgO, MgF2 giải thích tương tự.
3/ Đặc điểm của các hợp chất ion:
- Các hợp chất ion hầu hết là thể rắn ở nhiệt độ thường, khó tan chảy, khó bay hơi. Chẳng hạn, nhiệt độ nóng chảy của NaCl là 801 oC, nhiệt độ sôi của NaCl là 1465 oC.
- Khi các hợp chất này nóng chảy, hoặc hoà tan trong nước, lực hút tĩnh điện giữa các ion này yếu đi, kết quả là chúng phân li ra các ion trần, nên chúng dẫn điện tốt.
- Ở trạng thái rắn, các hợp chất ion không dẫn được điện.
Đúng 2
Bình luận (0)
Câu 5 ( 1 điểm ): Một hợp chất có phân tử gồm 2 nguyên tử P liên kết với 5 nguyên tử X và nặng hơn phân tử khí oxi 4,4375 lần.
(a) Tính phân tử khối của hợp chất.
(b) Tính nguyên tử khối của X, cho biết tên và kí hiệu hóa học của nguyên tố X.
a, PTK của hợp chất là 32.4,4375 = 142 (g/mol)
b,Ta có: \(2M_P+5M_X=142\)
\(\Leftrightarrow2.31+5M_X=142\)
\(\Leftrightarrow5M_X=80\Leftrightarrow M_X=16\left(g/mol\right)\)
⇒ X là nguyên tố oxi (O)
Đúng 3
Bình luận (0)
a, PTK của hợp chất là 32.4,4375 = 142 (g/mol)
b,Ta có: 2MP+5MX=1422MP+5MX=142
⇔2.31+5MX=142⇔2.31+5MX=142
⇔5MX=80⇔MX=16(g/mol)⇔5MX=80⇔MX=16(g/mol)
⇒ X là nguyên tố oxi (O)
Đúng 0
Bình luận (0)
Trong những nhận xét dưới đây, nhận xét nào không đúng ?A. Nguyên tử nitơ có hai lớp electron và lớp ngoài cùng có ba electron.B. Số hiệu nguyên tử của nitơ bằng 7.C. Ba electron ở phân lớp 2p của nguyên tử nitơ có thể tạo được ba liên kết cộng hoá trị với các nguyên tử khác.D. Cấu hình electron của nguyên tử nitơ là
1
s
2
2
s
2
3
s
3
và nitơ là nguyên tố p.
Đọc tiếp
Trong những nhận xét dưới đây, nhận xét nào không đúng ?
A. Nguyên tử nitơ có hai lớp electron và lớp ngoài cùng có ba electron.
B. Số hiệu nguyên tử của nitơ bằng 7.
C. Ba electron ở phân lớp 2p của nguyên tử nitơ có thể tạo được ba liên kết cộng hoá trị với các nguyên tử khác.
D. Cấu hình electron của nguyên tử nitơ là 1 s 2 2 s 2 3 s 3 và nitơ là nguyên tố p.