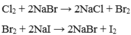Viết phương trình hóa học minh họa tính oxi hóa giảm dần trong dãy Cl2, Br2, I2.
H24
Những câu hỏi liên quan
So sánh tính chất oxi hóa của các đơn chất F2,Cl2, Br2, I2 và tính khử của những hợp chất HF, HCl, HBr, HI. Dẫn ra những phương trình hóa học để minh họa.
Tính oxi hóa giảm dần từ F2 đến I2.
- Flo là phi kim mạnh nhất, oxi hóa được tất cả các kim loại kể cả vàng và platin. Clo, Br và Iot tác dụng được với một số kim loại.
- Phản ứng với hiđro.

- Halogen đứng trước đẩy halogen đứng sau ra khỏi muối của chúng:
Cl2 + 2NaBr → 2NaCl + Br2
Br2 + 2NaI → 2NaBr + I2
Tính khử của axit tăng theo chiều: HF < HCl < HBr < HI.
- Chỉ có thể oxi hóa F- bằng dòng điện. Còn ion Cl-, Br-, I- đều có thể bị oxi hóa khi tác dụng với chất oxi hóa mạnh.
- HF hoàn toàn không thể hiện tính khử, HCl chỉ thể hiện tính khử khi tác dụng với những chất oxi hóa mạnh, còn HBr và nhất là HI có tính khử mạnh. Axit sunfuric đặc bị HBr khử đến SO2 và bị HI khử đến H2S:
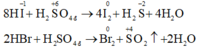
Đúng 1
Bình luận (0)
II-Tự luận
Dẫn ra các phản ứng hóa học chứng minh tính oxi hóa C l 2 > B r 2 > I 2 .
So sánh tc oxi hóa của các đơn chất F2. Cl2. Br2. I2. Dẫn ra pthh minh họa
Viết 4 phương trình hóa học chứng minh tính oxi hóa giảm dần từ Flo đến Iot
\(2F_2+2H_2O\rightarrow4HF+O_2\uparrow\) (Nước cháy khi tiếp xúc với Flo)
\(Cl_2+2KBr\rightarrow2KCl+Br_2\)
\(Br_2+2KI\rightarrow2KBr+I_2\)
\(I_2+H_2⇌2HI\)
Đúng 2
Bình luận (0)
Theo thứ tự: F2, Cl2, Br2, I2 thì:
A. tính oxi hóa tăng, độ dài liên kết tăng.
B. tính oxi hóa giảm, độ dài liên kết tăng.
C. tính oxi hóa tăng, độ dài liên kết giảm.
D. tính oxi hóa giảm, độ dài liên kết giảm.
Xem thêm câu trả lời
tìm các phản ứng hóa học chứng minh tính oxi hóa: F2<Cl2<Br2<I2 và O3>O2
Viết các phương trình hóa học hoàn thành dãy chuyển hóa sau (mỗi mũi tên tương ứngvới một phương trình hóa học, ghi rõ điều kiện nếu có): NaCl(1 ) Cl2 (2 ) Br2(3 ) HBr (4) HNO3
(1) \(2NaCl+2H_2O\underrightarrow{đpcmn}2NaOH+H_2+Cl_2\)
(2) \(2NaBr+Cl_2\rightarrow2NaCl+Br_2\)
(3) \(H_2+Br_2\underrightarrow{t^o}2HBr\)
(4) \(HBr+AgNO_3\rightarrow AgBr\downarrow+HNO_3\)
Đúng 1
Bình luận (0)
Viết các phương trình hóa học hoàn thành dãy chuyển hóa sau (mỗi mũi tên tương ứngvới một phương trình hóa học, ghi rõ điều kiện nếu có): NaCl(1 ) Cl2 ->(2 ) Br2->(3 ) HBr ->(4) HNO3
1. Viết các phương trình hóa học minh họa tính chất hóa học của oxi, hidro, phương trình hóa học điều chế oxi trong phòng thí nghiệm.2. Nhận biết khí oxi và hidro3. Bài toán đơn4. Bài toán tìm thành phần phần trăm các nguyên tố trong oxit hoặc lập công thức hóa học của oxit.5. Câu hỏi vận dụng: sự cháy, tính chất vật lí của hidro và oxiCÁC BN ƠI GIÚP MK VS SẮP THI HK R CÁC BN LM ƠN GIÚP MK VS
Đọc tiếp
1. Viết các phương trình hóa học minh họa tính chất hóa học của oxi, hidro, phương trình hóa học điều chế oxi trong phòng thí nghiệm.
2. Nhận biết khí oxi và hidro
3. Bài toán đơn
4. Bài toán tìm thành phần phần trăm các nguyên tố trong oxit hoặc lập công thức hóa học của oxit.
5. Câu hỏi vận dụng: sự cháy, tính chất vật lí của hidro và oxi
CÁC BN ƠI GIÚP MK VS SẮP THI HK R CÁC BN LM ƠN GIÚP MK VS
Những câu hỏi này là kiến thức cơ bản trong sách giáo khoa em nhé. Em chịu khó lấy sách ra đọc nha, khi nào mà không hiểu thì em có thể hỏi chị nha!
Đúng 1
Bình luận (0)
1. Viết các phương trình hóa học minh họa tính chất hóa học của oxi, hidro, phương trình hóa học điều chế oxi trong phòng thí nghiệm.2. Nhận biết khí oxi và hidro3. Bài toán đơn4. Bài toán tìm thành phần phần trăm các nguyên tố trong oxit hoặc lập công thức hóa học của oxit.5. Câu hỏi vận dụng: sự cháy, tính chất vật lí của hidro và oxiVD:Vì sao càng lên cao con người càng khó thở?Vì sao hiện nay người ta không dùng hidro để bơm vào khinh khí cầu như trước đây?Vì sao không dùng nước để dập tắt c...
Đọc tiếp
1. Viết các phương trình hóa học minh họa tính chất hóa học của oxi, hidro, phương trình hóa học điều chế oxi trong phòng thí nghiệm.
2. Nhận biết khí oxi và hidro
3. Bài toán đơn
4. Bài toán tìm thành phần phần trăm các nguyên tố trong oxit hoặc lập công thức hóa học của oxit.
5. Câu hỏi vận dụng: sự cháy, tính chất vật lí của hidro và oxi
VD:
Vì sao càng lên cao con người càng khó thở?
Vì sao hiện nay người ta không dùng hidro để bơm vào khinh khí cầu như trước đây?
Vì sao không dùng nước để dập tắt các đám cháy do xăng dầu gây ra?
Vì sao cần sục thêm oxi vào các hồ nuôi cá nhân tạo?
6. Phân loại và gọi tên oxit
CÁC BN ƠI GIÚP MK VS SẮP THI R LM ƠN GIÚP MK VS CÁC BN ƠI