Nguyên tử x có tổng số hạt cơ bản là 28 Trong đó số hạt không mang điện tích chiếm 35,7% xác định x
TL
Những câu hỏi liên quan
nguyên tử của nguyên tố X có tổng số hạt cơ bản là 28 hạt,trong đó số hạt không mang điện bằng 35,7% tổng số hạt.Xác định cấu tạo của nguyên tử X
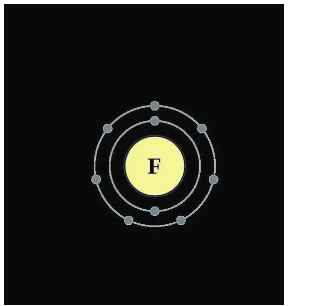
N=0,357.28=10
=> P=E=(28-10)/2=9
=> Z=9
=> Cấu tạo nguyên tử:
Đúng 2
Bình luận (0)
B1 : nguyên tử sắt có điện tích hạt nhân là +26.Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22. hãy xác định số hạt mỗi loại
B2: nguyên tử b có tổng số hạt là 28 số hạt không mang điện chiếm 35,7% tính số proton,neutron,electron
Bài 1:
\(Z^+=26^+\Rightarrow P=E=Z=26\\ 2P-N=22\Rightarrow N=2P-22=2.26-22=30\)
Đúng 1
Bình luận (0)
\(Bài.2:\\ N=35,7\%.28=10\\ \Rightarrow E=P=\dfrac{28-10}{2}=9\)
Đúng 0
Bình luận (0)
Số hạt mang điện tích p + e nhiều hơn số hạt ko mang điện tích n là 22.
Tức là ( p+e)-n = 22
Ta có điện tích hạt nhân à 26+, tức p = 26 (1)
Ta có (p+e)-n=22
Mà p = e ⇒⇒ 2p - n = 22 (2)
Thế (1) vào (2) ta được 2.26 - n =22
⇒⇒ n = 52 - 22=30
Số khối A = p + n = 26 + 30 = 56
Đúng 0
Bình luận (0)
a) nguyên tử X có tổng số 3 loại hạt p,n và e bằng 52 hạt trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt
b) một nguyên tử của nguyên tố Y có tổng số hạt là 28 (p,n và e) và số hạt không mang điện chiếm xấp xỉ 35,7%
hãy xác định số p,n và e và vẽ sơ đồ đơn giản của nguyên tử X,Y
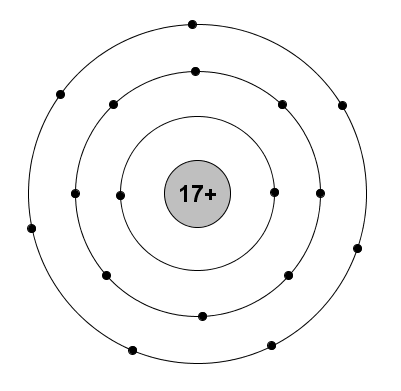
a. Nguyên tử X:
\(\left\{{}\begin{matrix}2P+N=52\\2P-N=16\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}P=17=E=Z\\N=18\end{matrix}\right.\)
Sơ đồ đơn giản:
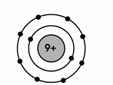
b. * Nguyên tử Y:
\(\left\{{}\begin{matrix}2P+N=28\\N\approx35,7\%.28=10\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}P=E=Z=9\\N=10\end{matrix}\right.\)
Sơ đồ cấu tạo nguyên tử Y:
Em tham khảo nha!
Đúng 2
Bình luận (0)
a.
Gọi: pX , eX , nX là các hạt trong X.
Khi đó :
\(2p_X+n_X=52\)
\(2p_X-n_X=16\)
\(\Rightarrow p_X=17,n_X=18\)

b.
Gọi: pY , eY , nY là các hạt trong Y.
Khi đó :
\(2p_Y+n_Y=28\)
\(n_Y=35.7\%\cdot28=10\) \(\Rightarrow p_Y=9\)
Đúng 3
Bình luận (0)
nguyên tử của nguyên tố X có tổng số hạt cơ bản (N,P,E) là 180 hạt. Trong đó tổng số hạt mang điện chiếm 58,89% tổng số hạt. Xác định số proton, electron,notron trong X
\(\left\{{}\begin{matrix}N+P+E=180\\P+E=58,89\%.180=106\\P=E\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}2P+N=180\\2P=106\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}P=E=Z=53\\N=74\end{matrix}\right.\)
Đúng 1
Bình luận (0)
tổng số hạt cơ bản trong nguyên tử X là 40 trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 20 xác định kí hiệu nguyên tử X xác định số lớp electron của nguyên tử X
Z=(S+a)/4=(40+20)/4=15 suy ra photpho. Photpho có 3 lớp e. Lớp thứ nhất có 2 e, lớp thứ 2 có 8 e, lớp thứ 3 có 5 e.
Đúng 0
Bình luận (0)
Nguyên tử của nguyên tố X có tổng số hạt cơ bản là 49, trong đó số hạt không mang điện bằng 53,125% số hạt mang điện diện tích hạt nhân của X là:
a. Xác định Z và A.
b. Xác định kí hiệu X.
Ta có: tổng số hat mang điện là 49 suy ra,ta có công thức
2Z + N = 49 (1)
Mà hạt kmd bằng..hạt mang,nên ta có
N = 53.125×2Z/100 (2)
Từ 1 và 2 ta có hệ pt:
suy ra N = 17
Z = 16
E = 16
từ trên bạn => là đuọc
Đúng 0
Bình luận (1)
Tổng số hạt trong nguyên tử x là 28 và số hạt không mang điện chiếm 35,7 % thì nguyên tử x là :
Giải thích và cách làm
1:Tổng số hạt cơ bản của nguyên tử nguyên tố X là 36.Trong đó số hạt mang điện gấp đôi số hạt không mang điện.Xác định số hiệu nguyên tử và số khối của nguyên tử X?2:Tổng số hạt trong nguyên tử là Y là 54 hạt,trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 14.a)Xác định các loại hạt trong Y b)Xác định đơn vị điện tích hạt nhân của Y c)Viết kí hiệu nguyên tử Y 3:Nguyên tử R có tổng số hạt là 115.Số hạt mang điện nhiều hơn số hạt không mang điện là 25.Xác định ngu...
Đọc tiếp
1:Tổng số hạt cơ bản của nguyên tử nguyên tố X là 36.Trong đó số hạt mang điện gấp đôi số hạt không mang điện.Xác định số hiệu nguyên tử và số khối của nguyên tử X?
2:Tổng số hạt trong nguyên tử là Y là 54 hạt,trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 14.
a)Xác định các loại hạt trong Y b)Xác định đơn vị điện tích hạt nhân của Y c)Viết kí hiệu nguyên tử Y
3:Nguyên tử R có tổng số hạt là 115.Số hạt mang điện nhiều hơn số hạt không mang điện là 25.Xác định nguyên tử R từ đó suy ra STT của R?
-Mình cần rất gấp,các bạn giúp mình với!-
1. Ta có tổng số hạt cơ bản của nguyên tố X là 36 , suy ra
p + e + n = 36 => 2p + n = 36
Số hạt mang điện gấp đôi số hạt không mang điện : 2p = 2n => p = n
Vậy : 3p = 36 => p = 12 => số p = số e = số z = 12
Số khối : A = p + n = 12 + 12 = 24
Đúng 2
Bình luận (3)
2.
a, Ta có tổng số hạt cơ bản là 54 hạt.
=> p+e+n=54 => 2p+n=54(1)
Vì số hạt mang điện nhiều hơn số hạt không mang điện là 14
=> 2p-n=14(2)
Từ (1) và (2) ta có hệ pt:
2p-n=14
2p+n=54
<=> p=17
n=20
Vậy e=17, p=17, n=20
b, số hiệu nguyên tử Z=17
c, kí hiệu: Cl
Đúng 2
Bình luận (1)
3.
Ntử R có tổng số hạt cơ bản là 115
=> p+e+n=115
=>2p+n=115(1)
Vì số hạt mang điện nhiều hơn số hạt không mang điện là 25
=> 2p-n=25(2)
Từ (1)&(2) => ta có hệ phương trình
=>2p+n=115
2p-n=25
<=>p=35
n=45
=> e=35, p=35, n=45
=> R là Br
STT của Br là 35
Đúng 1
Bình luận (0)
Xem thêm câu trả lời
Câu 2: Nguyên tử nguyên tố X có tổng số hạt cơ bản là 82, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22. Xác định số hiệu nguyên tử, số khối và kí hiệu nguyên tử X.
Tổng số hạt proton, nơtron và electron trong 1 nguyên tử nguyên tố X là 82:
p + e + n = 82 hay 2p + n = 82 (do p = e) (1)
Số hạt mang điện (p và e) nhiều hơn số hạt không mang điện (n) là 22 hạt
(p+e) – n = 22 hay 2p – n = 22 (2)
Giải (1), (2) ta có p = e = 26; n =30
Số khối của X = Z + N = p + n =56
Đúng 1
Bình luận (0)
Nguyên tử X có tổng số hạt cơ bản là 40. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. tìm số hạt p,n,e và xác định NTK của X