viết các phương pháp điều chế khí Hidro trong phòng thí nghiệm . viết 1 phương trình minh họa
LN
Những câu hỏi liên quan
Nêu phương pháp và vẽ hình mô tả quá trình điều chế khí clo trong phòng thí nghiệm? Viết phương trình hóa học minh họa và giải thích quá trình để thu được khí clo tinh khiết.
- Phương pháp điều chế clo trong phòng thí nghiệm: Đun nóng nhẹ dung dịch HCl đậm đặc với chất oxi hóa mạnh như MnO2 (hoặc KMnO4).
MnO2 + 4HCl \(\underrightarrow{t^o}\) MnCl2 + Cl2 + 2H2O
Để thu được khí clo tinh khiết:
- Bình H2SO4 đặc có tác dụng làm khô khí clo.
- Clo nặng hơn không khí Þ Thu bằng cách đẩy không khí.
- Bông tẩm xút: tránh để clo độc bay ra ngoài.
Đúng 0
Bình luận (0)
1. Viết các phương trình hóa học minh họa tính chất hóa học của oxi, hidro, phương trình hóa học điều chế oxi trong phòng thí nghiệm.2. Nhận biết khí oxi và hidro3. Bài toán đơn4. Bài toán tìm thành phần phần trăm các nguyên tố trong oxit hoặc lập công thức hóa học của oxit.5. Câu hỏi vận dụng: sự cháy, tính chất vật lí của hidro và oxiCÁC BN ƠI GIÚP MK VS SẮP THI HK R CÁC BN LM ƠN GIÚP MK VS
Đọc tiếp
1. Viết các phương trình hóa học minh họa tính chất hóa học của oxi, hidro, phương trình hóa học điều chế oxi trong phòng thí nghiệm.
2. Nhận biết khí oxi và hidro
3. Bài toán đơn
4. Bài toán tìm thành phần phần trăm các nguyên tố trong oxit hoặc lập công thức hóa học của oxit.
5. Câu hỏi vận dụng: sự cháy, tính chất vật lí của hidro và oxi
CÁC BN ƠI GIÚP MK VS SẮP THI HK R CÁC BN LM ƠN GIÚP MK VS
Những câu hỏi này là kiến thức cơ bản trong sách giáo khoa em nhé. Em chịu khó lấy sách ra đọc nha, khi nào mà không hiểu thì em có thể hỏi chị nha!
Đúng 1
Bình luận (0)
1. Viết các phương trình hóa học minh họa tính chất hóa học của oxi, hidro, phương trình hóa học điều chế oxi trong phòng thí nghiệm.2. Nhận biết khí oxi và hidro3. Bài toán đơn4. Bài toán tìm thành phần phần trăm các nguyên tố trong oxit hoặc lập công thức hóa học của oxit.5. Câu hỏi vận dụng: sự cháy, tính chất vật lí của hidro và oxiVD:Vì sao càng lên cao con người càng khó thở?Vì sao hiện nay người ta không dùng hidro để bơm vào khinh khí cầu như trước đây?Vì sao không dùng nước để dập tắt c...
Đọc tiếp
1. Viết các phương trình hóa học minh họa tính chất hóa học của oxi, hidro, phương trình hóa học điều chế oxi trong phòng thí nghiệm.
2. Nhận biết khí oxi và hidro
3. Bài toán đơn
4. Bài toán tìm thành phần phần trăm các nguyên tố trong oxit hoặc lập công thức hóa học của oxit.
5. Câu hỏi vận dụng: sự cháy, tính chất vật lí của hidro và oxi
VD:
Vì sao càng lên cao con người càng khó thở?
Vì sao hiện nay người ta không dùng hidro để bơm vào khinh khí cầu như trước đây?
Vì sao không dùng nước để dập tắt các đám cháy do xăng dầu gây ra?
Vì sao cần sục thêm oxi vào các hồ nuôi cá nhân tạo?
6. Phân loại và gọi tên oxit
CÁC BN ƠI GIÚP MK VS SẮP THI R LM ƠN GIÚP MK VS CÁC BN ƠI
1. Viết các phương trình hóa học minh họa tính chất hóa học của oxi, hidro, phương trình hóa học điều chế oxi trong phòng thí nghiệm.
2. Nhận biết khí oxi và hidro
3. Bài toán đơn
4. Bài toán tìm thành phần phần trăm các nguyên tố trong oxit hoặc lập công thức hóa học của oxit.
5. Câu hỏi vận dụng: sự cháy, tính chất vật lí của hidro và oxi
Viết phương trình phản ứng minh họa :
a) Trong phòng thí nghiệm khí oxi được điều chế bằng cách nung nóng kaliclorat
b) Hòa tan điphotpho pentaoxit vào nước thu được dung dịch axit photphoric
c) Cho bột sắt (III) oxit đi qua khí hidro nung nóng thu được sắt và hơi nước
d) Bỏ mẫu kali vào nước thì thấy sủi bọt khí không màu
\(a,2KClO_3\underrightarrow{t^o}2KCl+3O_2\\ b,P_2O_5+3H_2O\rightarrow2H_3PO_4\\ c,Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\\ c,2K+2H_2O\rightarrow2KOH+H_2\)
Đúng 6
Bình luận (0)
a)\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\uparrow\)
b)\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
c)\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
d)\(2K+2H_2O\rightarrow2KOH+H_2\uparrow\)
Đúng 4
Bình luận (0)
Hãy trình bày các phương pháp điều chế khí oxi trong phòng thí nghiệm và trong công nghiệp. Tại sao không áp dụng phương pháp điều chế khí trong phòng thí nghiệm, và ngược lại?
Điều chế oxi:
- Trong phòng thí nghiệm, oxi được điều chế bằng cách phân hủy những hợp chất giàu Oxi và ít bên với nhiệt như KMnO4, KClO3, ...
2KMnO4 → K2MnO4 + MnO2 + O2
2KClO3 → 2KCl + 3O2
- Trong công nghiệp:
a) Từ không khí: Không khí sau khi đã loại bỏ hết hơi nước, khí CO2, được hóa lỏng dưới áp suất 200 atm đồng thời hạ thấp nhiệt độ. Chưng cất phân đoạn không khí lỏng, thu được oxi lỏng. Oxi lỏng được vận chuyển trong những bình thép có thể tích 100 lít dưới áp suất 150atm.
b) Từ nước. Điện phân nước: 2H2O
Người ta không áp dụng phương pháp phòng thí nghiệm cho phòng thí nghiệm vì trong phòng thí nghiệm chỉ điều chế lượng nhỏ oxi, còn công nghiệp cần một lượng lớn giá thảnh rẻ.
Đúng 0
Bình luận (0)
Nêu nguyên liệu dùng để điều chế oxi, hidro trong phòng thí nghiệm. Viết pthh minh họa? Nguyên liệu dùng để điều chế oxi trong phòng thí nghiệm phải có đặc điểm gì? Không khí có thành phần như thế nào? Có thể thu khí oxi và hidro bằng những cách nào, tại sao?
Đọc tiếp
Nêu nguyên liệu dùng để điều chế oxi, hidro trong phòng thí nghiệm. Viết pthh minh họa? Nguyên liệu dùng để điều chế oxi trong phòng thí nghiệm phải có đặc điểm gì? Không khí có thành phần như thế nào? Có thể thu khí oxi và hidro bằng những cách nào, tại sao?
Viết phương trình phản ứng điều chế hidro trong phòng thí nghiệm.
Điều chế hidro trong phòng thí nghiệm:
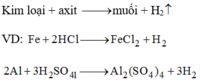
Đúng 0
Bình luận (0)
1. phương pháp thu khí hidro và oxi? giải thích tại sao?
2. nêu cách tiến hành thí nghiệm điều chế hidro và oxi trong phòng thí nghiệm
Cách thu khí ôxi : Bằng cách đẩy nước và đẩy không khí .
Cách thu khí hiđrô : Giống ôxi .
Cách tiến hành :
- Cho một lượng nhỏ (bằng hạt ngô) KMnO4 vào đáy ống nghiệm. Đặt một ít bồng gần miệng ống nghiệm.
- Dùng nút cao su có ống dẫn khí xuyên qua đậy kín ống nghiệm. Đặt ống nghiệm vào giá đỡ hoặc kẹp gỗ sao cho đáy ống nghiệm cao hơn miệng ống nghiệm chút ít.
- Nhánh dài của ống dẫn khí sâu gần sát đáy ống nghiệm (hoặc lọ thu).
- Dùng đèn cồn đun nóng cả ống nghiệm chứa KMnO4, sau đó tập trung đốt nóng phần có hóa chất. Kali pemanganat bị phân hủy tạo ra khí oxi. Nhận ra khí trong ống nghiệm (2) bằng que đóm còn hồng.
- Sau khi kiểm tra độ kín của các nút, đốt nóng ống nghiệm chứa KMnO4. Khí oxi sinh ra sẽ đẩy không khí hoặc đẩy nước và chứa trong ống nghiệm thu. Dùng nút cao su đậy kín ống nghiệm đã chứa đẩy bình oxi để dùng cho thí nghiệm sau.
Đúng 3
Bình luận (0)
1) Đẩy nước và đẩy không khí do tính không tan trong nước của hai khi và tính nặng hơn không khí của oxi và tính nhẹ hơn không khí của hidro
2)
- Điều chế H2 : Cho viên kẽm vào dung dịch HCl lấy dư
$Zn + 2HCl \to ZnCl_2 + H_2$
- Điều chế O2 :Nung KMnO4 trên ngọn lửa đèn cồn
$2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2$
Đúng 3
Bình luận (0)
Nêu phương pháp điều chế hidro, oxi trong phòng thí nghiệm? Cách thu khí hidro, oxi?
Cách điều chế oxi:dùng KMnO4,KClO3
Cách điều chế hidro:dùng kẽm và axit clohidric hay điện phân nước
Cách thu khí oxi:bằng cách đẩy nước và đẩy không khí
Cách thu khí hiđrô : giống oxi
Đúng 0
Bình luận (0)
điều chế O2 dùng KClO3 , KMnO4
điều chế H2 cho kim loại (Zn,Mg,...)vào axit(HCl,H2SO4,...)
cách thu H2,O2 : đẩy nước và đẩy kk
theo dõi mình nhé ♥♥♥
Đúng 0
Bình luận (0)





