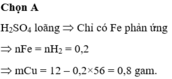Cho m(g) hỗn hợp Fe và Cu phản ứng với H2SO4 sinh ra 4,48 lít H2 và 6,4 chất rắn. Tính m.
H24
Những câu hỏi liên quan
Hỗn hợp M gồm Al, Al2O3, Fe3O4, CuO, Fe và Cu, trong đó oxi chiếm 20,4255% khối lượng hỗn hợp. Cho 6,72 lít khí CO (đktc) đi qua 35,25 gam M nung nóng, sau một thời gian thu được hỗn hợp rắn G và hỗn hợp khí X có tỉ khối so với H2 bằng 18. Hòa tan hết toàn bộ G trong lượng dư dung dịch HNO3 loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch chứa m gam muối (không có muối NH4NO3 sinh ra) và 4,48 lít (đktc) hỗn hợp khí Z gồm NO và N2O. Tỉ khối của Z so với H2 là 16,75. Giá trị của m...
Đọc tiếp
Hỗn hợp M gồm Al, Al2O3, Fe3O4, CuO, Fe và Cu, trong đó oxi chiếm 20,4255% khối lượng hỗn hợp. Cho 6,72 lít khí CO (đktc) đi qua 35,25 gam M nung nóng, sau một thời gian thu được hỗn hợp rắn G và hỗn hợp khí X có tỉ khối so với H2 bằng 18. Hòa tan hết toàn bộ G trong lượng dư dung dịch HNO3 loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch chứa m gam muối (không có muối NH4NO3 sinh ra) và 4,48 lít (đktc) hỗn hợp khí Z gồm NO và N2O. Tỉ khối của Z so với H2 là 16,75. Giá trị của m là
A. 96,25
B. 117,95
C. 139,50
D. 80,75
Cho 17,4 gam hỗn hợp X ( gồm A, Fe, Cu) vào V ml dung dịch H2So4 1M (lấy dư 10% so với lượng phản ứng), sau khi phản ứng kết thúc thu được 8,96 lít khí H2 (đktc) và 6,4 gam chất rắn
a) Tính khối lượng mỗi kim loại trong hỗn hợp X
b) Tính V
c) Cho 8,7 gam hỗn hợp X tan hoàn toàn trong dung dịch H2SO4 đặc, nóng thấy thu được 2,8 lít khí SO2 (đktc) và m gam S. Tính giá trị m
Cho 15,6g hỗn hợp gồm bột Fe và bột Cu tác dụng vừa đủ với 100g dung dịch HCl, thu được 4,48 lít khí H2 (đktc).a. Viết phương trình hóa học của phản ứng xảy ra ?b. Tính khối lượng các chất rắn ban đầu ?
Đọc tiếp
Cho 15,6g hỗn hợp gồm bột Fe và bột Cu tác dụng vừa đủ với 100g
dung dịch HCl, thu được 4,48 lít khí H2 (đktc).
a. Viết phương trình hóa học của phản ứng xảy ra ?
b. Tính khối lượng các chất rắn ban đầu ?
a)
$Fe + 2HCl \to FeCl_2 + H_2$
b)
Theo PTHH : $n_{Fe} = n_{H_2} = \dfrac{4,48}{22,4} = 0,2(mol)$
$\Rightarrow m_{Fe} = 0,2.56 = 11,2(gam)$
$\Rightarrow m_{Cu} = 15,6 - 11,2 = 4,4(gam)$
Đúng 1
Bình luận (0)
Cho m gam hỗn hợp Fe và Cu tác dụng với dung dịch H2SO4 loãng dư thu được 4,48 lít H2 (đktc). Nếu cho hỗn hợp trên phản ứng với dung dịch H2SO4 đặc nguội dư thu được 8,96 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Giá trị của m gần nhất là: A. 17,72 B. 36,91 C. 17,81 D. 36,82
Đọc tiếp
Cho m gam hỗn hợp Fe và Cu tác dụng với dung dịch H2SO4 loãng dư thu được 4,48 lít H2 (đktc). Nếu cho hỗn hợp trên phản ứng với dung dịch H2SO4 đặc nguội dư thu được 8,96 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Giá trị của m gần nhất là:
A. 17,72
B. 36,91
C. 17,81
D. 36,82
Bài 3. Cho 17,6 gam hỗn hợp Fe và Cu phản ứng với lượng dư dung dịch HCl loãng, sau phản ứng thu được 4,48 lít khí (đktc) a. Tính %m mỗi chất trong hỗn hợp ban đầu. b. Dẫn khí H2 thu được ở trên đi qua bột Fe2O3 nung nóng, tính khối lượng Fe tối đa có thể thu được
a) Ta có: nH2=4,48/22,4=0,2(mol)
PTHH: Fe +2 HCl -> FeCl2 + H2
0,2________0,4______0,2__0,2(mol)
mFe=0,2.56=11,2(g)
=> %mFe= (11,2/17,6).100=63,636%
=> %mCu= 36,364%
b) Fe2O3 + 3 H2 -to-> 2 Fe + 3 H2O
Ta có: nH2=0,2(mol) => nFe=2/3. 0,2= 2/15(mol)
=> mFe= 2/15 . 56=7,467(g)
Đúng 1
Bình luận (0)
Số moll của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,2 0,2
a) Số mol của sắt
nFe = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,2. 56
= 11,2 (g)
Khối lượng của đồng
mCu = 17,6 - 11,2
= 6,4 (g)
0/0Fe = \(\dfrac{m_{Fe}.100}{m_{hh}}=\dfrac{11,2.100}{17,6}=63,64\)0/0
0/0Cu = \(\dfrac{m_C.100}{m_{hh}}=\dfrac{6,4.100}{17,6}=36,36\)0/0
b) 3H2 + Fe2O3 → (to) 2Fe + 3H2O\(|\)
3 1 2 3
0,2 0,13
Số mol của sắt
nFe = \(\dfrac{0,2.2}{3}=0,13\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,13 . 56
= 7,28 (g)
Chúc bạn học tốt
Đúng 1
Bình luận (0)
Dẫn 6,72 lít khí hidro (đktc) đi qua 24 gam hỗn hợp CuO và Fe3O4 nung nóng, phản ứng xảy ra theo sơ đồ: H2+ CuO---> Cu + H2O
H2 + Fe3O4----> Fe + H2O
Sau khi phản ứng kết thúc thu được m gam chất rắn. Tính m
PTHH:
4H2+Fe3O4----->3Fe+4H2O
nH2=V/22,4=6,72/22,4=0,3mol
Theo PTHH:4molH2--->3molFe 0,3molH2->0,3.3/4=0,225molFe
mFe=nFe.M=0,225.56=12,6g
Đúng 0
Bình luận (0)
nO= nH2O= nH2= 0,3(mol)
m=m(oxit) - mO= 24- 0,3.16= 19,2(g)
Đúng 0
Bình luận (0)
Cho m gam hỗn hợp Cu, Fe phản ứng với lượng dư dd H₂SO₄, sau khi phản ứng kết thúc thu được 2,4g chất rắn và 6,72 lít khí thoát ra. Tính m.
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\\ Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ n_{Fe}=n_{H_2}=0,3mol\\ m_{rắn}=0,3.56+2,4=19,2g\)
Đúng 2
Bình luận (0)
Cho 12,0 gam hỗn hợp X gồm Cu và Fe vào dung dịch H2SO4 loãng (dư), kết thúc phản ứng thu được 4,48 lít H2 (đktc). Khối lượng của Cu trong m gam X là A. 0,8 gam B. 6,4 gam C. 5,6 gam D. 11,2 gam
Đọc tiếp
Cho 12,0 gam hỗn hợp X gồm Cu và Fe vào dung dịch H2SO4 loãng (dư), kết thúc phản ứng thu được 4,48 lít H2 (đktc). Khối lượng của Cu trong m gam X là
A. 0,8 gam
B. 6,4 gam
C. 5,6 gam
D. 11,2 gam
Cho 17,6 gam hỗn hợp Fe và Cu phản ứng với lượng dư dung dịch HCl loãng, sau phản ứng thu được 4,48 lít khí (đktc)
a. Tính %m mỗi chất trong hỗn hợp ban đầu.
b. Dẫn khí H2 thu được ở trên đi qua bột Fe2O3 nung nóng, tính khối lượng Fe tối đa có thể thu được?
Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,2 0,2
a) Số mol của sắt
nFe = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Khối lượng của sắt
mFe = nFe .MFe
= 0,2. 56
= 11,2 (g)
Khối lượng của đồng
mCu = 17,6 - 11,2
= 6,4 (g)
0/0Fe = \(\dfrac{m_{Fe}.100}{m_{hh}}=\dfrac{11,2.100}{17,6}=63,64\)0/0
0/0Cu = \(\dfrac{m_{Cu}.100}{m_{hh}}=\dfrac{6,4.100}{17,6}=36,36\)0/0
b) 3H2 + Fe2O3 → (to) 2Fe + 3H2O\(|\)
3 1 2 3
0,2 0,13
Số mol của sắt
nFe = \(\dfrac{0,2.2}{3}=0,13\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,13 . 56
= 7,28 (g)
Chúc bạn học tốt
Đúng 1
Bình luận (1)