Cho 100ml dd chứa Ba(OH)2 0,1M và KOH 0,2M vào 100ml dd chứa hcl 0,2M và HNO3 0,2M được dd Z. a) Tính pH của dung dịch Z b) tính nồng độ mol của 400ml dd nạo dùng để trung hòa hết dd Z
Khi cho 100ml dung dịch KOH 1M vào 100ml dung dịch HCl thu được dung dịch chứa 6,525 gam chất tan. Nồng độ mol (hoặc mol/l) của HCl trong dung dịch đã cho là
A. 0,75M. B. 1M. C. 0,25M. D. 0,5M
Xem thêm câu trả lời
Khi cho 100ml dung dịch KOH 1M vào 100ml dung dịch HCl thì phản ứng xảy ra vừa đủ. Nồng độ mol của HCl trong dung dịch đã dùng là
A. 1,0M
B. 0,25M
C. 0,5M
D. 0,75M
Đáp án : A
Phản ứng vừa đủ :
nNaOH = nHCl = 0,1 mol
=> CM(HCl) = 1M
Đúng 0
Bình luận (0)
Khi cho 100ml dung dịch KOH 1M vào 100ml dung dịch HCl thì phản ứng xảy ra vừa đủ. Nồng độ mol của HCl trong dung dịch đã dùng là A. 1,0M B. 0,25M C. 0,5M D. 0,75M
Đọc tiếp
Khi cho 100ml dung dịch KOH 1M vào 100ml dung dịch HCl thì phản ứng xảy ra vừa đủ. Nồng độ mol của HCl trong dung dịch đã dùng là
A. 1,0M
B. 0,25M
C. 0,5M
D. 0,75M
Đáp án A
nKOH = 0,1.1=0,1 (mol)
KOH + HCl →KCl + H2O
0,1→ 0,1 (mol)
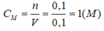
Đúng 0
Bình luận (0)
. Cho 0,2 mol Na2O tác dụng vừa đủ với 100ml dung dịch HCl. Nồng độ mol/lít của dung dịch axit cần dùng là A. 1M. B. 2M. C. 3M. D. 4M.Giải ra giúp mik vs ạMik cần gấp ạ
Đọc tiếp
. Cho 0,2 mol Na2O tác dụng vừa đủ với 100ml dung dịch HCl. Nồng độ mol/lít của dung dịch axit cần dùng là
A. 1M. B. 2M. C. 3M. D. 4M.
Giải ra giúp mik vs ạ
Mik cần gấp ạ
D. 4M
\(Na_2O + 2HCl \rightarrow 2NaCl + H_2O\)
Theo PTHH:
\(n_{HCl}= 2n_{Na_2O}= 2 . 0,2 = 0,4 mol\)
\(\Rightarrow C_M= \dfrac{n_{HCl}}{V_{HCl}}= \dfrac{0,4}{0,1}= 4M\)
Đúng 1
Bình luận (0)
Khi cho 100ml dung dịch KOH 1M vào 100ml dung dịch HCl thu được dung dịch có chứa 6,525 gam chất tan. Nồng độ mol của HCl trong dung dịch đã dùng là
A. 0,75M
B. 1M
C. 0,25M
D. 0,5M
Đáp án D
Gọi số mol HCl là x mol
HCl + KOH → KCl + H2O
x x (mol)
Giả sử KOH hết ⇒ mKCl = 74,5 . 0,1 = 7.45(g) > 6,525 ⇒KOH dư ,HCl hết.
(0,1 - x).56 + x.(39 + 35,5) = 6,525
⇒ x = 0,05 mol ⇒ CM = 0,5M
Đúng 0
Bình luận (0)
1)Trộn lẫn 100ml dung dịch K2SO4 0,5M và 200ml dung dịch Fe2(SO4)3 0,1M và với 100ml dung dịch MgCl2 0,2M. Tính nồng độ mol/l của các ion trong dung dịch sau cùng.2) Một dung dịch KOH có nồng độ mol/l ion OH- gấp 4 lần trong dung dịch Ba(OH)2 0,1M.a) Tính nồng độ dung dịch KOH.b) Nếu trộn mỗi dung dịch 200ml với nhau thì được dung dịch mơi có nồng độ ion OH- bao nhiêu?
Đọc tiếp
1)Trộn lẫn 100ml dung dịch K2SO4 0,5M và 200ml dung dịch Fe2(SO4)3 0,1M và với 100ml dung dịch MgCl2 0,2M. Tính nồng độ mol/l của các ion trong dung dịch sau cùng.
2) Một dung dịch KOH có nồng độ mol/l ion OH- gấp 4 lần trong dung dịch Ba(OH)2 0,1M.
a) Tính nồng độ dung dịch KOH.
b) Nếu trộn mỗi dung dịch 200ml với nhau thì được dung dịch mơi có nồng độ ion OH- bao nhiêu?
tính nồng độ của các chất sau: 100ml dung dịch gồm 0,1 mol HCL và 0,2 mol H2SO4....
Cho 100ml dung dịch KOH 1M vào 100ml dung dịch HCl thu được dung dịch có chứa 6,525 gam chất tan. Nồng độ mol của dung dịch HCl đã dùng là
A. 1 M
B. 0,5 M
C. 0,75M
D. 0,25M
Đáp án : B
+) TH1 : Dung dịch sau có KCl và KOH dư
=> nKCl = nHCl = x mol ; nKOH dư = 0,1 – x
=> mchất tan = 74,5x + 56(0,1 – x) = 6,525g
=> x = 0,05 mol => CM(HCl) = 0,5M
Không cần xét TH HCl dư
Đúng 0
Bình luận (0)
Khi cho 100ml dung dịch KOH 1M vào 100mk dung dịch HCl thu được dung dịch có chứa 6,525g chất tam. Nồng độ mol của HCl trong dung dịch đã dùng là bao nhiêu
$KOH + HCl \to KCl + H_2O$
Giả sử $KOH$ hết
$n_{KCl} = n_{KOH} = 0,1.1 = 0,1(mol)$
$m_{KCl} =0,1.74,5 = 7,45(gam) > 6,525(gam)$
Suy ra $KOH$ dư. Gọi $C_{M_{HCl}} = a(M)$
Theo PTHH :
$n_{KOH\ pư} = n_{KCl} = n_{HCl} = 0,1a(mol)$
Suy ra :
$(0,1 - 0,1a).56 + 0,1a.74,5 = 6,525 \Rightarrow a = 0,5(M)$
Đúng 1
Bình luận (2)
Cách 2 : $n_{K^+} = n_{OH^-} = n_{KOH} = 0,1(mol)$
$C_{M_{HCl} } = aM \Rightarrow n_{H^+} = n_{Cl^-} = n_{HCl} = 0,1a(mol)$
Chứng minh KOH dư tương tự cách trên.
OH- + H+ → H2O
0,1a.......0,1a......................(mol)
Dung dịch sau phản ứng gồm :
$OH^- : 0,1 -0,1a(mol)$
$K^+ : 0,1(mol)$
$Cl^- : 0,1a(mol)$
Suy ra: $(0,1- 0,1a).17 + 0,1.39 + 0,1a.35,5 = 6,525 \Rightarrow a = 0,5$
Đúng 1
Bình luận (0)









