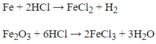khối lượng hỗn hợp gồm : 15g CaCO3 và 2 mol HCl, (Cl = 35,5 , H = 1)
VM
Những câu hỏi liên quan
Tính khối lượng dung dịch HCl 7,3% cần để hòa tan hết 24 g hỗn hợp gồm CuO và F e 2 O 3 có số mol bằng nhau (H=1, Cu=64, Fe=56, O=16, Cl=35,5).
Gọi x là số mol của CuO hay của F e 2 O 3 , ta có: 80x + 160x = 24
Suy ra x = 0,1 mol
C u O + 2 H C l → C u C l 2 + H 2 O F e 2 O 3 + 6 H C l → 2 F e C l 3 + 3 H 2 O
Số mol HCl cần = 8x = 0,8 mol. Khối lượng HCl = 0,8 x 36,5 = 29,2 gam.
Khối lượng dung dịch HCl 7,3% = (29,2 x 100)/7,3 = 400 gam.
Đúng 0
Bình luận (0)
Câu 1: Hòa tan 9,2g hỗn hợp gồm: Mg và MgO vào dung dịch HCl 14,6% vừa đủ. Sau phản ứng thu được 1,12 lít khí ở đktc.
a)Viết PTHH
b)Tính khối lượng Mg và MgO trong hỗn hợp đầu.
c)Tính khối lượng dung dịch axit HCl 14,6% đã dùng.( Cho Mg = 24; Cl= 35,5; H = 1; O = 16;)
Câu 1: Hòa tan 9,2g hỗn hợp gồm: Mg và MgO vào dung dịch HCl 14,6% vừa đủ. Sau phản ứng thu được 1,12 lít khí ở đktc.a)Viết PTHHb)Tính khối lượng Mg và MgO trong hỗn hợp đầu.c)Tính khối lượng dung dịch axit HCl 14,6% đã dùng.( Cho Mg 24; Cl 35,5; H 1; O 16;)Câu 2: Hòa tan hoàn toàn 21 gam hỗn hợp CuO và Zn vào dd H2SO4 0,5M thu được 4,48 lit khí thoát ra ở đktc.a) Viết các phương trình phản ứng xảy ra?b) Tính tỉ lệ % theo khối lượng các chất rắn có trong hỗn hợp đầu?c) Tính thể t...
Đọc tiếp
Câu 1: Hòa tan 9,2g hỗn hợp gồm: Mg và MgO vào dung dịch HCl 14,6% vừa đủ. Sau phản ứng thu được 1,12 lít khí ở đktc.
a)Viết PTHH
b)Tính khối lượng Mg và MgO trong hỗn hợp đầu.
c)Tính khối lượng dung dịch axit HCl 14,6% đã dùng.( Cho Mg = 24; Cl= 35,5; H = 1; O = 16;)
Câu 2: Hòa tan hoàn toàn 21 gam hỗn hợp CuO và Zn vào dd H2SO4 0,5M thu được 4,48 lit khí thoát ra ở đktc.
a) Viết các phương trình phản ứng xảy ra?
b) Tính tỉ lệ % theo khối lượng các chất rắn có trong hỗn hợp đầu?
c) Tính thể tích dd H2SO4 đã dùng? (Cho Cu =64, Zn =65, H =1, S =32, O =16)
Câu 3: Cho 80 gam dung dịch NaOH 10% tác dụng vừa đủ với dd MgSO4 10%.
a. Nêu hiện tượng và viết phương trình hóa học? Tính khối lượng chất rắn thu được ?
b. Tính khối lượng dd muối MgSO4 tham gia phản ứng ?
c. Tính nồng độ phần trăm dung dịch muối sau phản ứng
Câu 4: Cho 11,2 gam bột sắt tan vừa đủ trong dung dịch axit sunfuric 20% (khối lượng riêng của dung dịch là 1,2 gam/ml). Tính thể tích dung dịch axit sunfuric cần dùng?
Câu 5: Cho 400ml dd HCl 0,5 M tác dụng với 100 gam dd Ba(OH)2 16%. Tính khối lượng các chất sau phản ứng
MỌI NGƯỜI ƠI XIN GIÚP MÌNH VỚI
Tính phân tử khối (khối lượng mol M) của: H2SO4, H3PO4, HCl, HNO3, CaO, SO2, P2O5, MgO, N2O, CaCO3, MgCl2, FeCl3. (Biết: H = 1, Ca = 40, N = 14, O = 16, S = 32, P = 31, Mg = 24, Fe = 56, Cl = 35,5, C = 12)
cho 27,2 g hỗn hợp A gồm Fe và Fe2O3 tác dụng với dung dịch HCl 20% thu được 4,48 lít H2(đktc) với dd B tính
a) khối lượng mỗi chất trong hh A
b) khối lượng dung dịch HCl 20% cần dùng
c) nồng độ phần trăm các chất có trong dd b
Fe=56 H=1 Cl=35,5 O=16
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
a) Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)=n_{Fe}\)
\(\Rightarrow m_{Fe}=0,2\cdot56=11,2\left(g\right)\) \(\Rightarrow m_{Fe_2O_3}=16\left(g\right)\)
b+c) Ta có: \(\left\{{}\begin{matrix}n_{Fe}=0,2\left(mol\right)\\n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{HCl}=2n_{Fe}+6n_{Fe_2O_3}=1\left(mol\right)\) \(\Rightarrow m_{ddHCl}=\dfrac{36,5}{20\%}=182,5\left(g\right)\)
Mặt khác: \(n_{FeCl_2}=0,2\left(mol\right)=n_{H_2}=n_{FeCl_3}\) \(\Rightarrow\left\{{}\begin{matrix}m_{FeCl_2}=0,2\cdot127=25,4\left(g\right)\\m_{FeCl_3}=0,2\cdot162,5=32,5\left(g\right)\\m_{H_2}=0,2\cdot2=0,4\left(g\right)\end{matrix}\right.\)
\(\Rightarrow m_{dd}=m_{hhA}+m_{ddHCl}-m_{H_2}=209,3\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{FeCl_2}=\dfrac{25,4}{209,3}\cdot100\%\approx12,14\%\\C\%_{FeCl_3}=\dfrac{32,5}{209,3}\cdot100\%\approx15,53\%\end{matrix}\right.\)
Đúng 3
Bình luận (0)
\(n_{H2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,2 0,4 0,2 0,2
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O|\)
1 6 2 3
0,1 0,6 0,2
a) \(n_{Fe}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(m_{Fe}=0,2.56=11,2\left(g\right)\)
\(m_{Fe2O3}=27,2-11,2=16\left(g\right)\)
b) Có : \(m_{Fe2O3}=16\left(g\right)\)
\(n_{Fe2O3}=\dfrac{16}{160}=0,1\left(mol\right)\)
\(n_{HCl\left(tổng\right)}=0,4+0,6=1\left(mol\right)\)
⇒ \(m_{HCl}=1.36,5=36,5\left(g\right)\)
\(m_{ddHCl}=\dfrac{36,5.100}{20}=182,5\left(g\right)\)
c) \(n_{FeCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{FeCl2}=0,2.127=25,4\left(g\right)\)
\(n_{FeCl3}=\dfrac{0,6.2}{6}=0,2\left(mol\right)\)
⇒ \(m_{FeCl3}=0,2.162,5=32,5\left(g\right)\)
\(m_{ddspu}=27,2+182,5-\left(0,2.2\right)=209,3\left(g\right)\)
\(C_{FeCl2}=\dfrac{25,4.100}{209,3}=12,14\)0/0
\(C_{FeCl3}=\dfrac{32,5.100}{209,3}=15,53\)0/0
Chúc bạn học tốt
Đúng 0
Bình luận (0)
Cho hỗn hợp gồm Fe, F e 2 O 3 tác dụng với dung dịch Hcl thu được 4,48 lít khí (đktc) và một dung dịch có chứa 57,9g hỗn hợp 2 muối. Tính khối lượng mỗi muối (Fe=56, Cl=35,5, Al=27).
Bài 1.Cho 15g hỗn hợp gồm Fe và Cu tác dụng hết với 200ml dung dịch HCl, thu được 3,36 lit khí.
a.Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu.
b.Tính nồng độ mol CM của dung dịch HCl
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{Fe}=n_{H_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(\Rightarrow m_{Fe}=0.15\cdot56=8.4\left(g\right)\)
\(m_{Cu}=m_{hh}-m_{Fe}=15-8.4=6.6\left(g\right)\)
\(n_{HCl}=2n_{H_2}=0.15\cdot2=0.3\left(mol\right)\)
\(C_{M_{HCl}}=\dfrac{0.3}{0.2}=1.5\left(M\right)\)
Đúng 3
Bình luận (0)
Cho 15 gam hỗn hợp gồm Al và Mg tác dụng hoàn toàn với dung dịch HCl. Biết nhôm chiếm 36% khối lượng trong hỗn hợp ban đầu. Thể tích hiđro (đktc) thu được sau khi phản ứng là(Cho H1, Mg 24, Al 27, Cl 35,5) 11,2 lít.13,44 lít15,68 lít.7,84 lít.
Đọc tiếp
Cho 15 gam hỗn hợp gồm Al và Mg tác dụng hoàn toàn với dung dịch HCl. Biết nhôm chiếm 36% khối lượng trong hỗn hợp ban đầu. Thể tích hiđro (đktc) thu được sau khi phản ứng là
(Cho H=1, Mg = 24, Al = 27, Cl= 35,5)
11,2 lít.13,44 lít15,68 lít.7,84 lít.
Lập hệ phương trình ( Al là x , Mg là y )
\(\left\{{}\begin{matrix}27x+24y=15\\27x=\dfrac{36}{100}.15\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,4\end{matrix}\right.\)
2Al + 6HCl ---> 2AlCl3 + 3H2
0,2 0,3
2Mg + 4HCl ---> 2MgCl2 + 2H2
0,4 0,4
\(\Sigma n_{H2\uparrow}=0,3+0,4=0,7\left(mol\right)\)
\(\Rightarrow V_{H2\uparrow}=0,7.22,4=15,68\left(l\right)\)
Đúng 1
Bình luận (0)
cho 23,75g hỗn hợp gồm zn và Fe tác dụng hết với dung dịch HCl,thoát ra 8,96 lít H_2 a. Tính khối lượng và phần trăm mỗi khối lượng b. Khối lượng muối tạo thành Biết Fe là 56 Zn 65 Cl là 35,5
Gọi số mol Zn, Fe là a, b (mol)
=> 65a + 56b = 23,75 (1)
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
a--------------->a------->a
Fe + 2HCl --> FeCl2 + H2
b----------------->b----->b
=> a + b = 0,4 (2)
(1)(2) => a = 0,15 (mol); b = 0,25 (mol)
=> mZn = 0,15.65 = 9,75 (g); mFe = 0,25.56 = 14 (g)
\(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{9,75}{23,75}.100\%=41,05\%\\\%m_{Fe}=\dfrac{14}{23,75}.100\%=58,95\%\end{matrix}\right.\)
b) mZnCl2 = 0,15.136 = 20,4 (g)
mFeCl2 = 0,25.127 = 31,75 (g)
=> mmuối = 20,4 + 31,75 = 52,15 (g)
Đúng 1
Bình luận (0)