Trình bày cách pha 100ml dung dịch NaOH 0.05N biết MnaoH= 40g/mol
VT
Những câu hỏi liên quan
Hãy trình bày cách pha chế :
a) 150g dung dịch CuSO4 2% từ dung dịch CuSO4 20%
b) 2 50 ml dung dịch NaOH 9,5 M từ dung dịch NaOH 2M
a)
m CuSO4 = 150.2% = 3(gam)
m dd CuSO4 20% = 3/20% = 15(gam)
m nước cần thêm = 150 - 15 = 135(gam)
Pha chế :
- Chuẩn bị 15 gam dd CuSO4 20% vào cốc
- Đong thêm 135 gam nước cho vào cốc, khuấy đều.
b) n NaOH = 0,25.9,5 = 2,375(mol)
V dd NaOH 2M = 1,1875(lít) = 1187,5(ml)
V nước cần bay hơi = 1187,5 - 250 = 937,5(ml)
- Chuẩn bị 1,1875 lít NaOH 2M vào cốc 2 lít có chia vạch
- Đun từ từ hỗn hợp cho nước bay hơi đến khi nước chạm vạch 250 ml thì dừng lại
Đúng 2
Bình luận (0)
\(a.\)
\(m_{CuSO_4}=150\cdot2\%=3\left(g\right)\)
\(m_{dd_{CuSO_4}}=\dfrac{3}{20\%}=15\left(g\right)\)
\(m_{H_2O\left(ct\right)}=150-15=135\left(g\right)\)
Chuẩn bị 15 gam dung dịch CuSO4 20% vào cốc 1 lít
Đong thêm 135 gam nước vào cốc,khuấy đều
\(b.\)
Anh sửa lại đề là : 0.5 M nhé !
\(n_{NaOH}=0.25\cdot0.5=0.125\left(mol\right)\)
\(V_{dd_{NaOH}}=\dfrac{0.125}{2}=0.0625\left(l\right)=62.5\left(ml\right)\)
\(V_{H_2O}=250-62.5=187.5\left(ml\right)\)
Chuẩn bị 62.5 ml dd NaOH 2M vào cốc 500 ml
Đong thêm 187.5 ml nước vào cốc,khuấy đều
Đúng 0
Bình luận (0)
Hãy trình bày cách pha chế:
a) 150 g dung dịch CuSO4 2% từ dung dịch CuSO4 20%
b) 250 ml dung dịch NaOH 0,5 M từ dung dịch NaOH 2M
a) Khối lượng chất tan cần để pha 150 g dung dịch CuSO4 2%: 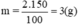
Khối lượng dung dịch CuSO4 20% ban đầu có chứa 3 g CuSO4: 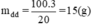
Khối lượng nước cần pha chế là: mnước = 150 – 15 = 135 g.
Pha chế: lấy 15 g dung dịch CuSO4 20% vào cốc thêm 135 g H2O vào và khuấy đều, được 150g dung dịch CuSO4 2%.
b) Số mol chất tan trong 250 ml dung dịch NaOH 0,5M.
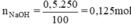
Thể tích dung dịch NaOH 2M có chứa 0,125 mol NaOH là:
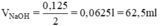
Pha chế: Đong lấy 62,5 ml dung dịch NaOH 2M cho vào cốc chia độ có dung tích 500ml. Thêm từ từ nước cất vào cốc đến vạch 250 ml và khuấy đều ta được 250 ml dung dịch 0,5M.
Đúng 0
Bình luận (0)
1. Trình bày cách pha chế 200 g dung dịch NaCl 15% 2. Cần thêm bao nhiêu gam Na2O vào 400 gam dung dịch NaOH 10% để dung dịch NaOH 25%
1)
m NaCl = 200.15% = 30(gam)
m H2O = 200 -30 = 170(gam)
- Pha chế : Cân lấy 30 gam NaCl cho vào cốc. Đong lấy 170 gam nước cho vào cốc khuấy đều
2) n Na2O = a(mol)
m NaOH = 400.15% = 40(gam)
Na2O + H2O → 2NaOH
a...............a............2a..........(mol)
Sau pư :
m dd = 400 + 62a - 18a = 400 + 44a(gam)
m NaOH = 2a.40 + 40 = 80a + 40(gam)
=> C% NaOH = (80a + 40) / (400 + 44a) .100% = 25%
=> a = 20/23
=> m Na2O = 62. 20/23 = 53,91 gam
Đúng 2
Bình luận (0)
Từ NaOH, nước cất và các dụng cụ cần thiết, hãy tính toán và trình bày cách pha chế
a) 800ml dung dịch NaOH2M
b) 800gam dung dịch NaOH 10%
a) n NaOH = 0,8.2 = 1,6 mol
m NaOH = 1,6.40 = 64 gam
Cân lấy 64 gam NaOH cho vào cốc có chia vạch
Thêm từ từ nước cho đến khi chạm vạch 800ml thì dừng lại,khuấy đều
b) m NaOH = 800.10% = 80(gam)
m H2O = 800 - 80 = 720 gam
Cân lấy 80 gam NaOH cho vào cốc có dung dịch 5 lít
Thêm 720 gam nước vào cốc, khuấy đều.
Đúng 1
Bình luận (4)
a) nNaOH= 2.0,8=1,6(mol)
PTHH: Na + H2O -> NaOH + 1/2 H2
=> nNa=1,6(mol)
=> Cho 800 ml nước vào 1,6 mol Na để tạo ra 800ml dung dịch NaOH 2M.
b) mNaOH= 800.10%=80(g)
=> nNaOH=80/40=2(mol)
PTHH: Na + H2O -> NaOH + 1/2 H2
=> nNa=2(mol) => mNa=2.23=46(g)
mH2= 1.2=2(g)
=> mH2O= mNaOH+ mH2- mNa= 800+ 2 - 2.23= 757g)
=> Điều chế: cho 756(g) nước vào 46 gam Na sẽ tạo ra 800 gam dd NaOH 10%.
Đúng 1
Bình luận (0)
a. Số mol NaOH có trong 800ml dd NaOH 2M là : 0,8.2=1,6 mol
\(\Rightarrow\)mNaOH=1,6.40=64 gam
\(\Rightarrow\) mH2O= 800-64=736 gam
Cách pha chế : Cho 64 gam NaOH vào bình tam giác, sau đó cho 746 gam nước cất vào bình, khuấy đều ta được 800ml dd NaOH 2M
b. Số gam NaOH có trong 800g dd NaOH 10% là : \(\dfrac{x}{800}x100\%=10\%\Rightarrow x=80gam\)
\(\Rightarrow\)mH2O=800-80=720 gam
Cách pha chế : CHo 80 gam NaOH vào bình tam giác, sau đó cho 720 g nước cất vào bình, khuấy đều ta được 800g dd NaOH 10 %
Đúng 1
Bình luận (2)
từ các dung dịch hcl 36 % (d = 1,18g/ml ) , H2So4 96% ( d = 1,84g/mL)
. pha 100mL dung dịch HCL 0,1M
. pha 100ml dung dịch h2so4 0.05M
b. Từ tinh thể NaOH 96% hãy tính pha 100ml NaOH 25%
Hãy trình bày cách pha chế 0,5 lít dung dịch NaOH 10% có khối lượng riêng là 1,109g/ml
1) Gọi thể tích các dung dịch NaOH có nồng độ 3% và 10% cần dùng lần lượt là V_1 và V_2.
m_NaOH 3%= 1,05(V_1)3%= 0,0315V_1.
m_NaOH 10% =1,12(V_2)10%= 0,112V_2.
m_NaOH 8%= 1,1.2000.8% =176.
Theo đề bài ta có hệ phương trình:
0,0315V_1 + 0,112V_2= 176 ∩ V_1+ V_2 =2000 => V_1= 96000/161 (mℓ), V_2= 226000/161 (mℓ).
Đúng 3
Bình luận (1)
- Tính toán:
Ta có: \(D=\dfrac{m_{dd_{NaOH}}}{0,5}=1,109\left(\dfrac{g}{ml}\right)\)
\(\Rightarrow m_{dd_{NaOH}}=0,5545\left(g\right)\)
Ta lại có: \(C_{\%_{NaOH}}=\dfrac{m_{NaOH}}{0,5545}.100\%=10\%\)
\(\Rightarrow m_{NaOH}=0,05545\left(g\right)\)
\(\Rightarrow m_{H_2O}=0,5545-0,05545=0,49905\left(g\right)\)
- Cách pha:
+ Chọn bình có thể tích trên 0,5 lít.
+ Cho 0,49905 gam nước vào bình.
+ Sau đó cho 0,05545 gam NaOH vào, khuấy đều là được dung dịch NaOH 10%.
Đúng 1
Bình luận (0)
Dung dịch NaOH nồng độ 10% có khối lượng riêng là 1.109 g/ml
a, Hãy trình bày cách điều chế 5 lít dung dịch NaOHnồng độ 10%
b, Hãy trình bày nộng độ mol của dung dịch đó
Mọi người giúp mình với ạ![]()
a)
$m = D.V = 1,109.5.1000 =5545(gam)$
$m_{NaOH} = 5545.10\% = 554,5(gam)$
Pha :
- Cân lấy 554,5 gam NaOH khan cho vào cốc dung dịch 10 lít có chia vạch
- Thêm từ từ nước vào cho đến khi chạm vạch 5 lít, khuấy đều.
b)
$n_{NaOH} = \dfrac{545,5}{40} = 13,8625(mol)$
$C_{M_{NaOH}} = \dfrac{13,8625}{5} = 2,7725M$
Đúng 3
Bình luận (0)
Hãy trình bày cách pha chế 150ml dung dịch H N O 3 0,25M bằng cách pha loãng dung dịch H N O 3 5M có sẵn
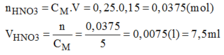
* Cách pha chế:
- Đong lấy 7,5ml dung dịch H N O 3 5M cho vào bình chứa.
- Cho thêm dần dần nước cất vào bình cho đến đủ 150ml lắc đều, ta được 150m dung dịch H N O 3 cần pha chế.
Đúng 0
Bình luận (0)
1. Biết rằng 1,12 lít khí cacbon đioxit (đktc) tác dụng với 100ml dung dịch NaOH tạo muối trung hòa.a. Viết phương trình phản ứng hóa học xảy ra.b. Tính nồng độ mol của dung dịch NaOH đã dùng.2. Hòa tan CuO vào 200g dung dịch HCl 7,3%.a. Viết phương trình phản ứng hóa học xảy ra.b. Tính khối lượng CuO tham gia phản ứng.c. Tính nồng độ phần trăm của dung dịch muối tạo thành.
Đọc tiếp
1. Biết rằng 1,12 lít khí cacbon đioxit (đktc) tác dụng với 100ml dung dịch NaOH tạo muối trung hòa.
a. Viết phương trình phản ứng hóa học xảy ra.
b. Tính nồng độ mol của dung dịch NaOH đã dùng.
2. Hòa tan CuO vào 200g dung dịch HCl 7,3%.
a. Viết phương trình phản ứng hóa học xảy ra.
b. Tính khối lượng CuO tham gia phản ứng.
c. Tính nồng độ phần trăm của dung dịch muối tạo thành.
1.
a, \(n_{CO_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: CO2 + 2NaOH → Na2CO3 + H2O
Mol: 0,05 0,1
b, \(C_{M_{ddNaOH}}=\dfrac{0,1}{0,1}=1M\)
2.
a, \(m_{HCl}=200.7,3\%=14,6\left(g\right)\Rightarrow n_{HCl}=\dfrac{14,6}{36,5}=0,4\left(mol\right)\)
PTHH: CuO + 2HCl → CuCl2 + H2O
Mol: 0,2 0,4 0,2
b,\(m_{CuO}=0,2.80=16\left(g\right)\)
c, \(C\%_{ddCuCl_2}=\dfrac{0,2.135.100\%}{16+200}=12,5\%\)
Đúng 2
Bình luận (2)
PTHH: CuO + 2HCl → CuCl2 + H2O
Mol: 0,2 0,4 0,2
b,
Đúng 1
Bình luận (1)





