Cho sơ đồ phản ứng sau: FeS → + HCL khí X → + O 2 khí Y → + Br 2 + H 2 O H 2 SO 4
Các chất X, Y lần lượt là:
A. SO2, hơi S
B. H2S, hơi S
C. H2S, SO2
D. SO2,H2S
Cho sơ đồ phản ứng sau:
F e S → ( 1 ) + H C l k h í X → ( 2 ) + O 2 k h í Y → ( 3 ) + B r 2 + H 2 O H 2 S O 4
Các chất X, Y lần lượt là:
A. SO2, hơi S.
B. H2S, hơi S.
C. H2S, SO2.
D. SO2, H2S.
Đáp án C.
FeS + 2HCl→ FeCl2 + H2S
2H2S + 3O2 → 2SO2 + 2H2O
Bài 1:Cho sơ đồ phản ứng sau: Mg + HCl ->MgCl2 + H2Nếu cho 2,4g Mg tác dụng với 3,65g HCl. Chất nào còn dư sau phản ứng? Tính khối lượng còn dư? Tính khối lượng MgCl2 tạo thành và thể tích khí H2 thu được (đktc)Bài 2:Cho sơ đồ phản ứng sau: Al + H2SO4 -> Al2(SO4)3 + H2Nếu có 5,4g nhôm tác dụng với 14,7g H2SO4. Chất nào còn dư sau phản ứng? Tính khối lượng còn dư? Tính khối lượng Al2(SO4)3 tạo thành và thể tích khí H2 thu được (đktc)Bài 3: Hòa tan hoàn toàn 3,78g với kim loại M (hóa trị III) vào dung dịch HCl thu được 4,704l khí H2 (đktc). Xác định kim loại M?Bài 4: Cho sơ đồ phản ứng sau: KMnO4 -> ..........+...........+O2Tính thể tích Oxi (đktc) thu được khi nhiệt phân hủy hoàn toàn 0,4 mol KMnO4Đốt cháy 6,2g photpho trong bình chứa lượng Oxi ở trên. Tính khối lượng điphotpho pentaoxit?
Nếu có thể thì lần sau bạn nên đăng tách từng bài ra nhé!
Bài 1:
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Ta có: \(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
\(n_{HCl}=\dfrac{3,65}{36,5}=0,1\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,1}{2}\) , ta được Mg dư.
Theo PT: \(n_{Mg\left(pư\right)}=n_{MgCl_2}=n_{H_2}=\dfrac{1}{2}n_{HCl}=0,05\left(mol\right)\)
\(\Rightarrow n_{Mg\left(dư\right)}=0,1-0,05=0,05\left(mol\right)\)
\(\Rightarrow m_{Mg\left(dư\right)}=0,05.24=1,2\left(g\right)\)
\(m_{MgCl_2}=0,05.95=4,75\left(g\right)\)
\(V_{H_2}=0,05.22,4=1,12\left(l\right)\)
Bài 2:
PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{14,7}{98}=0,15\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{2}>\dfrac{0,15}{3}\) , ta được Al dư.
Theo PT: \(\left\{{}\begin{matrix}n_{Al\left(pư\right)}=\dfrac{2}{3}n_{H_2SO_4}=0,1\left(mol\right)\\n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{3}n_{H_2SO_4}=0,05\left(mol\right)\\n_{H_2}=n_{H_2SO_4}=0,15\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{Al\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\)
\(\Rightarrow m_{Al\left(dư\right)}=0,1.27=2,7\left(g\right)\)
\(m_{Al_2\left(SO_4\right)_3}=0,05.342=17,1\left(g\right)\)
\(V_{H_2}=0,15.22,4=3,36\left(l\right)\)
Bài 3:
PT: \(2M+6HCl\rightarrow2MCl_3+3H_2\)
Ta có: \(n_{H_2}=\dfrac{4,704}{22,4}=0,21\left(mol\right)\)
Theo PT: \(n_M=\dfrac{2}{3}n_{H_2}=0,14\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{3,78}{0,14}=27\left(g/mol\right)\)
Vậy: M là nhôm (Al).
Bài 4:
PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{KMnO_4}=0,2\left(mol\right)\)
PT: \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
Ta có: \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{4}>\dfrac{0,2}{5}\) , ta được P dư.
Theo PT: \(n_{P_2O_5}=\dfrac{2}{5}n_{O_2}=0,08\left(mol\right)\)
\(\Rightarrow m_{P_2O_5}=0,08.142=11,36\left(g\right)\)
Bạn tham khảo nhé!
Cho sơ đồ phản ứng: Fe + X → FeS.
X là:
A. SO3
B. H2S
C. SO2
D. S
Cho 13g kẽm tác dụng với HCl theo sơ đồ phản ứng
Z n + H C l → Z n C l 2 + H 2
Tính thể tích khí H 2 (ĐKTC) đã sinh ra sau phản ứng
Cho các sơ đồ phản ứng :
Zn + HCl → Khí A + ...
KMnO4 + HCl → Khí B + ...
KMnO4 ![]() Khí C + ...
Khí C + ...
Các khí sinh ra (A, B, C) có khả năng phản ứng với nhau là:
A. A và B, B và C
B. A và B, A và C
C. A và C, B và C
D. A và B, B và C, A và C
Đáp án B
Zn + 2HCl ® ZnCl2 + H2 (A)
KMnO4 + HCl ® KCl + MnCl2 + H2O + Cl2 (B)
2KMnO4 ![]() K2MnO4 + MnO2 + O2(C)
K2MnO4 + MnO2 + O2(C)
Cho các phản ứng sau:
(1) Na2SO3+ HCl → khí X
(2) KMnO4 → khí Y
(3) Ca(HCO3)2 + HCl → khí Z
(4) FeS + HCl → khí T
Cho hỗn hợp chứa các khí trên đi qua bình đựng dung dịch NaOH dư. Số khí thoát ra khỏi bình là:
A. 2.
B. 4.
C. 3.
D. 1.
Đáp án D.
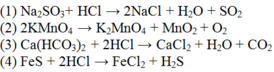
Khí thoát ra khỏi bình là khí không phản ứng với NaOH. O2 không phản ứng với NaOH.
5/Cho sơ đồ phản ứng sau : Zn + HCl - - > ZnCl2 + H2
Nếu có 6,5 g Zn tham gia phản ứng, hãy tìm:
a) Thể tích khí H2 thu được ở điều kiện tiêu chuẩn.
b) Khối lượng axit HCl cần dùng .
c) Khối lượng ZnCl2 tạo thành sau phản ứng ( theo 2 cách)
\(nZn=\dfrac{6,5}{65}=0,1mol\)
PTHH:
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,1--->0,2------->0,2------>0,1
a, \(VH_2=0,1.22,4=2,24lít\)
b, \(mHCl=0,2.36,5=3,65g\)
c, cách 1:
\(mZnCl_2=0,2.136=27,2gam\)
cách 2 :
\(mH_2=0,1.2=0,2gam\)
BTKL: mZn+mHCl=mZnCl2+H2
6,5+3,65 =mZnCl2+0,2
sao cái cách 2 btkl mình cs tính kq mà s nhìn nó lạ lắm
5/
a) \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,1 0,2 0,1 0,1
\(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
b) \(m_{HCl}=0,2.36,5=7,3\left(g\right)\)
c) \(m_{ZnCl_2}=0,1.136=13,6\left(g\right)\)
62.Cho sơ đồ phản ứng sau: Fe + O2 (A); (A) + HCl (B) + (C) + H2O; (B) + NaOH (D) + (G); (C) + NaOH (E) + (G); (D) + ? + ? (E); Xác định các chất trong sơ đồ và hoàn thành phương trình phản ứng. Câu 64. Đốt 5,6 gam Fe trong không khí, thu được m gam hỗn hợp chất rắn X. Cho toàn bộ X tác dụng với dung dịch HNO3 loãng (dư), thu được khí 1,12 lít khí NO (sản phẩm khử duy nhất của N+5). Câu 65. Hòa tan 1,12 gam Fe bằng 300 ml dung dịch HCl 0,2M, thu được dung dịch X và khí H2. Cho dung dịch AgNO3 dư vào X, thu được khí NO (sản phẩm khử duy nhất của N+5) và m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Tính m. Giúp mình vs ạ.
Hình dưới đây là sơ đồ tượng trưng cho phản ứng giữa khí hidro H 2 và khí clo C l 2 tạo ra axit clohidric HCl.
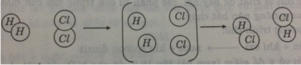
Hãy cho biết:
Trước và sau phản ứng số nguyên tử mỗi nguyên tố có thay đổi không?
Trước và sau phản ứng số nguyên tử mỗi nguyên tố không thay đổi.