Cho một lá sắt vào 160 gam dung dịch CuSO 4 10%. Sau khi Cu bị đẩy hết ra khỏi dung dịch CuSO 4 và bám hết vào lá sắt, thì khối lượng lá sắt tăng lên 4%. Xác định khối lượng lá sắt ban đầu.
NN
Những câu hỏi liên quan
Cho một lá kẽm có khối lượng 50g vào dung dịch CuSO4. Sau khi phản ứng kết thúc, đem lá kẽm ra rửa nhẹ, làm khô, cân được 49.82 gam. Hãy tính khối lượng CuSO4 trong dung dịch.
Gọi x là số mol Zn p.ứ
Zn + CuSO4 = ZnSO4 + Cu
x x x (mol)
Vì khi phản ứng Zn tác dụng với CuSO4 và Cu bám trên bề mặt lá kẽm nên sau phản ứng ta thu được 49,82g khối lượng chất rắn gồm Zn dư và Cu
Ta có: 65x - 64x = 50 - 49,82 = 0,18(g)
=> x = 0,18 (mol)
Khối lượng CuSO4 trong dung dịch là
0,18 x 160 = 28,8 (g)
Đúng 0
Bình luận (0)
Ngâm một lá đồng vào 340 gam dung dịch AgNO3 10%. Sau khi tất cả bạc bị đẩy ra khỏi dung dịch AgNO3 và bám hết vào lá đồng, thì khối lượng lá đồng tăng lên 38%. Xác định khối lượng lá đồng ban đầu.
Ngâm một lá đồng vào 340 gam dung dịch AgNO3 10%. Sau khi tất cả bạc bị đẩy ra khỏi dung dịch AgNO3 và bám hết vào lá đồng, thì khối lượng lá đồng tăng lên 38%. Xác định khối lượng lá đồng ban đầu.
Đọc tiếp
Ngâm một lá đồng vào 340 gam dung dịch AgNO3 10%. Sau khi tất cả bạc bị đẩy ra khỏi dung dịch AgNO3 và bám hết vào lá đồng, thì khối lượng lá đồng tăng lên 38%. Xác định khối lượng lá đồng ban đầu.
Ngâm 1 lá Sắt vào 320 gam dung dịch CuSO4 10%. Sau khi tất cả đồng đẩy ra khỏi dd CuSO4 và bám hết vào miếng sắt tăng lên 8%. Xác định khối lượng miếng sắt ban đầu
Ta có: mCuSO4=(320x10):100=32g=>nCuSO4=32:160=0...
ptpu: Fe + CuSO4 => FeSO4 + Cu
0,2 0,2 mol 0,2 mol
Độ tăng khối lượng của miếng sắt là: 0,2x(64-56)=1,6g
Theo đề: độ tăng của miếng sắt là 8% nên
1,6g -------> 8%
20g <--------- 100%
Vậy khối lượng miếng sắt ban đầu là 20g
BẠN THAM KHẢO
Đúng 0
Bình luận (1)
Ngâm một lá sắt có khối lượng 2,5 gam trong 25 ml dung dịch CuSO4 15% có khối lượng riêng là 1,12 g/ml. Sau một thời gian phản ứng, người ta lấy lá sắt ra khỏi dung dịch, rửa nhẹ, làm khô thì cân nặng 2,58 gam.
a) Hãy viết phương trình hoá học.
b) Tính nồng độ phần trăm của các chất trong dung dịch sau phản ứng.
* Nhận xét: “sau một thời gian phản ứng”, suy ra CuSO4 có thể vẫn còn dư. Gọi số mol Fe phản ứng là x mol.
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
P/ư: x x x x mol
Khối lượng lá sắt tăng = 2,58 - 2,5 = 0,08 gam. Ta có phương trình:
64x - 56x = 0,08
x = 0,01 mol
b) Sô mol CuS04 ban đầu = 0,02625 mol
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:
mdd = + mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
C%, CuS04 = .100% ≈ 9,32%
C%, FeSO4 = .100% ≈ 5,45%
Đúng 1
Bình luận (0)
\(m_{ddCuSO_4}\) = 25.1,12 = 28g\(\Rightarrow m_{CuSO_4}\) = 4,2g\(\Rightarrow n_{CuSO_4}\) = 0,02625mol
Fe + CuSO4\(\rightarrow\) FeSO4 + Cu
x \(\rightarrow\) x-----------------x---------x
\(m_{tăng}\) = 64x-56x = 0,08g \(\Rightarrow\) x=0,01mol
\(n_{Fe\left(bđ\right)}\) = 5/112 mol \(\Rightarrow\) Fe dư, CuSO4 dư ( vì phản ứng ko hoàn toàn)
\(\Rightarrow\)trong dd sau pứ có \(FeSO_4=0,01mol\); \(CuSO_4=0,01625mol\)
mdd = mCuSO4 + mFepư - mCu = mddCuSO4 - \(m_{giảm}\) =28 - 0,08 = 27,92g
\(\Rightarrow\) C% FeSO4 = 0,01(56 + 96).100/ 27,92 = 5,44%
C% CuSO4 = 0,01625.(64 + 96).100/27,92 = 9,31%
Đúng 0
Bình luận (0)
cho một lá sắt vào dung dịch CuSO4 10% dư, sau một thời gian lấy lá sắt ra rửa nhẹ và lau khô, cân lại thấy lá sắt tăng thêm 1 (g) so với khối lượng ban đầu của nó, biết rằng toàn bộ đồng sinh ra bám vào lá sắt
a) Viết phương trình phản ứng
b) Tính khối lượng đồng sinh ra
c) Tính khối lượng dung dịch CuSO4 tham gia phản ứng
Ngâm một lá sắt có khối lượng 2,5 gam trong 25 ml dung dịch CuSO4 15% có khối lượng riêng là 1,12 g/ml. Sau một thời gian phản ứng, người ta lấy lá sắt ra khỏi dung dịch, rửa nhẹ, làm khô thì cân nặng 2,58 gam.
a) Hãy viết phương trình hoá học.
b) Tính nồng độ phần trăm của các chất trong dung dịch sau phản ứng.
Bạn xem câu trả lời của mình nha :
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
P/ư: x x x x mol
Khối lượng lá sắt tăng = 2,58 - 2,5 = 0,08 gam. Ta có phương trình:
64x - 56x = 0,08
x = 0,01 mol
b) Sô mol CuS04 ban đầu = 0,02625 mol
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:
mdd = + mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
C%, CuS04 = .100% ≈ 9,32%
C%, FeSO4 = .100% ≈ 5,45%
Đúng 0
Bình luận (0)
Ngâm một lá sắt có khối lượng 2,5 gam trong 25 ml dung dịch CuSO4 15% có khối lượng riêng là 1,12 g/ml. Sau một thời gian phản ứng, người ta lấy lá sắt ra khỏi dung dịch, rửa nhẹ, làm khô thì cân nặng 2,58 gam.
a) Hãy viết phương trình hoá học.
b) Tính nồng độ phần trăm của các chất trong dung dịch sau phản ứng.
* Nhận xét: “sau một thời gian phản ứng”, suy ra CuSO4 có thể vẫn còn dư. Gọi số mol Fe phản ứng là x mol.
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
P/ư: x x x x mol
Khối lượng lá sắt tăng = 2,58 - 2,5 = 0,08 gam. Ta có phương trình:
64x - 56x = 0,08
x = 0,01 mol
b) Sô mol CuS04 ban đầu = 0,02625 mol
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:
mdd = + mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
C%, CuS04 = .100% ≈ 9,32%
C%, FeSO4 = .100% ≈ 5,45%
Đúng 0
Bình luận (0)
* Nhận xét: “sau một thời gian phản ứng”, suy ra CuSO4 có thể vẫn còn dư.
Gọi số mol Fe phản ứng là x mol.
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
1 mol Fe phản ứng thì khối lượng sắt tăng: 64-56 = 8 gam
x mol Fe → 2,58 -2,5 = 0,08 gam
⇒ x = 0,01 mol
b) Số mol CuSO4 ban đầu
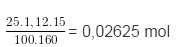
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:

Đúng 0
Bình luận (0)
Cho 0,25 mol CuO tan hết trong dung dịch H 2 SO 4 20% đem nung nóng lượng vừa đủ, xảy ra phản
ứng : CuO + H 2 SO 4 CuSO 4 + H 2 O
Sau đó làm nguội dung dịch đến 10 o C .Tính khối lượng tinh thể CuSO 4 .5H 2 O đã tách ra khỏi dung
dịch ? Biết độ tan của CuSO 4 ở 10 o C là 17,4 gam . Biết rằng khối lượng mol của CuSO 4 .5H 2 O bằng
250 gam và số mol của CuSO 4 bằng CuSO 4 .5H 2 O.
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
0,25mol...........0,25mol..........0,25mol
mCuSO4= 0,25.160=40g
mdd sau = \(0,25.80+\dfrac{98.0,25.100}{20}=142,5g\)
mH2O = 142,5 - 40 =102,5 g
khi hạ nhiệt độ :
\(CuSO_4+5H_2O\rightarrow CuSO_4.5H_2O\)
Gọi x là số mol tách ra khỏi dung dịch sau khi hạ nhiệt độ :
khối lượng CuSO4 còn lại : 40- 160x
khối lượng nước còn lại : 102,5-90x
Độ tan : \(17,4=\dfrac{\left(40-160x\right).100}{102,5-90x}\Rightarrow x=0,15mol\)
\(\Rightarrow m_{CuSO_4.5H_2O\left(tach\right)}=0,15.150=38,3g\)
Đúng 1
Bình luận (5)
Theo đề bài ta có :
Độ tan của CuSO4 ở 100c là 17,4 g
=> mct=mCuSO4=17,4 g
=> nCuSO4=\(\dfrac{17,4}{160}\approx0,109\left(mol\right)\)
Ta có pt phản ứng :
CuO + H2SO4 \(\rightarrow\) CuSO4 + H2O
Ta có tỉ lệ :
nCuO=\(\dfrac{0,25}{1}mol>nCuSO4=\dfrac{0,109}{1}mol\)
=> số mol của CuO dư ( tính theo số mol của CuSO4)
Theo đề bài ta có :
nCuSO4.5H2O=nCuSO4=0,109 mol
=> mCuSO4.5H2O=0,109.250=27,25 (g)
Vậy khối lượng của CuSO4.5H2O đã tách ra khỏi dung dịch là 27,25 (g)
Đúng 0
Bình luận (1)




