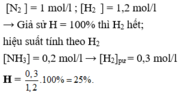Thực hiện phản ứng tổng hợp amoniac :
N 2 + 3 H 2 ↔ 2 NH 3
Nồng độ mol ban đầu của các chất như sau :
[ N 2 ] = 1 mol/l ; [ H 2 ] = 1,2 mol/l
Khi phản ứng đạt cân bằng nồng độ mol của [ NH 3 ] = 0,2 mol/1. Tính hiệu suất của phản ứng tổng hợp amoniac.



 .
.