Muối nào trong đó có kim loại hóa trị II trong các muối sau: A l 2 S O 4 3 ; N a 2 S O 4 ; K 2 S O 4 ; B a C l 2 ; C u S O 4
A. K 2 S O 4 ; B a C l 2
B. A l 2 S O 4 3
C. B a C l 2 ; C u S O 4
D. N a 2 S O 4
Hòa tan 3,82 hỗn hợp hai muối sunfat của hai kim loại A, B có hóa trị tương ứng là I và II vào H2O, sau đó thêm BaCl2 vào thu được 6,99 g BaSO4.
a, Tính khối lượng muối clorua thu được.
b, Xác định 2 kim loại và khối lượng mỗi muối trong hỗn hợp ban đầu.
- Gọi công thức chung của hai muối là : \(M_2\left(SO_4\right)_n\)
\(PTHH:M_2\left(SO_4\right)_n+nBaCl_2\rightarrow nBaSO_4+2MCl_n\)
................0,03/n..................................0,03................
\(\Rightarrow\dfrac{0,03}{n}=\dfrac{3,82}{2M+96n}\)
\(\Rightarrow M=\dfrac{47}{3}n\)
Mà \(1< n< 2\)
\(\Rightarrow\dfrac{47}{3}< \dfrac{47}{3}n< \dfrac{94}{3}\)
\(\Rightarrow\dfrac{47}{3}< M< \dfrac{94}{3}\)
Nên A và B có thể là : Na và Mg .
- Gọi Na2SO4 và MgSO4 có mol là a, b .
b, \(BT_{SO_4^{-2}}=a+b=0,03\)
\(PTKL:142a+120b=3,82\)
\(\Rightarrow\left\{{}\begin{matrix}a=0,01\\b=0,02\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Na2SO4}=1,42g\\m_{MgSO4}=2,4g\end{matrix}\right.\)
a, \(m_{MCl}=m_{NaCl}+m_{MaCl2}=2,485g\)
Câu b á thiếu dữ kiện nhe (mk bổ sung thêm là 2 kl này phải cùng vị trị chu kì )
a) PTHH: A2SO4+BaCl2 \(\rightarrow\) 2ACl+BaSO4
BSO4+BaCl2 \(\rightarrow\) BCl2+BaSO4
nBaCl2 = nBaSO4 = \(\dfrac{6.99}{233}\) = 0,03mol
\(\Rightarrow\)mBaCl2 = 0,03.208 = 6,24g.
b)mhh =3,82g
nSO4(2-)=0,03mol
-Nếu hh chỉ có A2SO4, MA2SO4\(=\dfrac{3,82}{0,03}=127,33\rightarrow M_A=15,67\)
-Nếu hh chỉ có BSO4, MBSO4\(=\dfrac{3,82}{0,03}=127,33\rightarrow M_B=31,33\)
Mà hh có cả A2SO4 và BSO4 nên
15,67 Mà A,B ở cùng chu kỳ nên A là Na (23) và B là Mg (24)
Cho dung dịch NaOH vào dung dịch muối sunfat của kim loại hóa trị II thấy sinh ra kết tủa tan trong dung dịch NaOH dư. Đó là muối nào sau đây?
A. MgSO4.
B. CaSO4.
C. MnSO4.
D. ZnSO4.
Cho dung dịch NaOH vào dung dịch muối sunfat của kim loại hóa trị II thấy sinh ra kết tủa tan trong dung dịch NaOH dư. Đó là muối nào sau đây?
A. MgSO4.
B. CaSO4.
C. MnSO4.
D. ZnSO4.
\(2NaOH+ZnSO_4\rightarrow Zn\left(OH\right)_2+Na_2SO_4\\ Zn\left(OH\right)_2+2NaOH\rightarrow Na_2ZnO_2+2H_2O\)
Cho dung dịch NaOH vào dung dịch muối sunfat của kim loại hóa trị II thấy sinh ra kết tủa tan trong dung dịch NaOH dư. Đó là muối nào sau đây?
A. MgSO4
B. CaSO4
C. MnSO4
D. ZnSO4
Đáp án D.
PTHH:
2NaOH + ZnSO4 → Na2SO4 + Zn(OH)2↓
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O
cái chỗ muối cacbonat hoá trị II đó các bạn hiểu là kim loại trong muối đó có hoá trị II nhé 
Theo ĐLBT KL, ta có: m muối cacbonat = m chất rắn + mCO2
⇒ mCO2 = 13,4 - 6,8 = 6,6 (g)
\(\Rightarrow n_{CO_2}=\dfrac{6,6}{44}=0,15\left(mol\right)\)
Có: \(n_{NaOH}=0,075.1=0,075\left(mol\right)\)
\(\Rightarrow\dfrac{n_{NaOH}}{n_{CO_2}}=\dfrac{0,075}{0,15}=0,5\)
Vậy: Pư tạo muối NaHCO3.
PT: NaOH + CO2 → NaHCO3
___0,075__________0,075 (mol)
⇒ mNaHCO3 = 0,075.84 = 6,3 (g)
Bạn tham khảo nhé!
Hòa tan hoàn toàn 23,8 gam hỗn hợp một muối cacbonat của các kim loại hóa trị I và muối cacbonat của kim loại hóa trị II trong dung dịch HCl. Sau phản ứng thu được 4,48 lít khí (đktc). Đem cô cạn dung dịch thu được thì khối lượng muối khan là:
A. 13 g
B. 15 g
C. 26 g
D. 30 g
Đáp án C
Gọi công thức của hai muối trong hỗn hợp ban đầu là A2CO3 và BCO3.
Có các phản ứng:
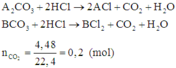
Quan sát phản ứng thấy khi cho hỗn hợp phản ứng với dung dịch HCl thì mỗi gốc C O 3 2 - trong muối được thay thế bởi hai gốc Cl-.
Có 1 mol C O 3 2 - bị thay thế bởi 2 mol Cl- thì khối lượng của muối tăng: (2.35,5 -60) = 11(gam)
Do đó khối lượng muối khan thu được khi cô cạn dung dịch là:
mmuối clorua = mmuối cacbonat + 0,2.11 = 23,8 + 0,2.11= 26 (gam)
cho a gam một kim loại có hóa trị II tan hết trong dung dịch HNO3 dư, sau phản ứng thu được 66,15 gam muối kim loại, axit dư và hỗn hợp khí X gồm NO và NO2 . Tỉ khối của X so với H2 bằng 20. Tìm kim loại đó
\(Đặt:n_A=x\left(mol\right),n_{NO}=a\left(mol\right),n_{NO_2}=b\left(mol\right)\)
\(Giảsử:n_{khí}=1\left(mol\right)\)
\(\Rightarrow a+b=1\left(mol\right)\left(1\right)\)
\(\overline{M_{khí}}=\dfrac{30a+46b}{a+b}=20\cdot2\)
\(\Leftrightarrow30a+46b=40\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.375,b=0.625\)
\(BTe:2n_A=3n_{NO}+n_{NO_2}\Rightarrow n_A=\dfrac{3\cdot0.375+0.625}{2}=0.875\left(mol\right)\)
\(m_{A\left(NO_3\right)_2}=0.875\cdot\left(A+124\right)=66.15\left(g\right)\\ \Rightarrow A=\)
Đến đây bạn xem lại đề nhé.
Đề có thiếu thể tích hỗn hợp khí không bạn ơi ?
Mấy bạn giải hộ mình với ạ
Câu 5: Hòa tan 24,9 gam hỗn hợp X gồm kim loại A (hóa trị II) và kim loại B (hóa trị III) trong dung dịch
HCl vừa đủ, sau phản ứng thu được dung dịch muối và 14,874 L khí hydrogen. Biết tỉ lệ số mol A : B bằng
3 : 2 và MA > 60 g/mol. Xác định hai kim loại A, B.
Câu 6: Hòa tan hoàn toàn 19,85 gam hỗn hợp hai kim loại Mg và Zn trong dung dịch HCl 29,2% (lấy dư
20% so với lượng cần phản ứng), sau phản ứng thu được dung dịch chứa 54,09 gam chất tan.
a) Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu.
b) Tính nồng độ % dung dịch thu được sau phản ứng.
Câu 7: Cho 12 gam hỗn hợp A gồm Fe và kim loại M (hóa trị II không đổi) vào dung dịch HCl dư thu được
2,479 lít khí H2.. Mặt khác khi cho 12 gam hỗn hợp trên tác dụng với hết với khí Cl2 ở nhiệt độ cao thì thấy
lượng Cl2 phản ứng tối đa là 6,1975 lít (phản ứng sinh ra FeCl3 và MCl2). Biết các phản ứng xảy ra hoàn
toàn, các thể tích khí đo ở điều kiện chuẩn. Tìm kim loại M.
dung dịch X và 10,4118 L khí hydrogen Câu 8: Hòa tan hỗn hợp bột Fe, Al trong dung dịch H2SO4 34,3% vừa đủ (loãng), sau phản ứng thu được
(điều kiện chuẩn). Biết tỉ lệ mol của Fe và Al bằng 3 : 5. Tính nồng
độ % của dung dịch X.
Câu 5:
Ta có: \(n_{H_2}=\dfrac{14,874}{24,79}=0,6\left(mol\right)\)
Gọi: nA = 3x (mol) ⇒ nB = 2x (mol)
PT: \(A+2HCl\rightarrow AlCl_2+H_2\)
\(2B+6HCl\rightarrow2BCl_3+3H_2\)
Theo PT: \(n_{H_2}=n_A+\dfrac{3}{2}n_B\)
⇒ 0,6 = 3x + 3/2.2x
⇒ x = 0,1 (mol)
⇒ nA = 0,3 (mol), nB = 0,2 (mol)
Mà: mA + mB = 24,9
⇒ 0,3.MA + 0,2.MB = 24,9
\(\Rightarrow M_A=\dfrac{24,9-0,2M_B}{0,3}>60\)
⇒ MB < 34,5 (g/mol) → MB = 27 (g/mol) → Al
MA = 65 (g/mol) → Zn
Câu 6:
a, PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Gọi: \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Zn}=y\left(mol\right)\end{matrix}\right.\) ⇒ 24x + 65y = 19,85 (1)
Theo PT: \(\left\{{}\begin{matrix}n_{MgCl_2}=n_{Mg}=x\left(mol\right)\\n_{ZnCl_2}=n_{Zn}=y\left(mol\right)\end{matrix}\right.\)
\(n_{HCl\left(pư\right)}=2n_{Mg}+2n_{Zn}=2x+2y\left(mol\right)\)
⇒ nHCl (dư) = (2x + 2y).20% (mol)
⇒ 95x + 136y + (2x + 2y).20%.36,5 = 54,09 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,15\left(mol\right)\\y=0,25\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,15.24}{19,85}.100\%\approx18,14\%\\\%m_{Zn}\approx81,86\%\end{matrix}\right.\)
b, Ta có: nHCl (pư) = 0,15.2 + 0,25.2 = 0,8 (mol) ⇒ nH2 = 1/2nHCl = 0,4 (mol)
nHCl (dư) = 0,8.20% = 0,16 (mol)
\(\Rightarrow m_{ddHCl}=\dfrac{\left(0,8+0,16\right).36,5}{29,2\%}=120\left(g\right)\)
⇒ m dd sau pư = 19,85 + 120 - 0,4.2 = 139,05 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{HCl}=\dfrac{0,16.36,5}{139,05}.100\%\approx4,20\%\\C\%_{MgCl_2}=\dfrac{0,15.95}{139,05}.100\%\approx10,25\%\\C\%_{ZnCl_2}=\dfrac{0,25.136}{139,05}.100\%\approx24,45\%\end{matrix}\right.\)
Câu 7:
Ta có: 56nFe + MM.nM = 12
- Cho pư với HCl
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(M+2HCl\rightarrow MCl_2+H_2\)
Theo PT: \(n_{H_2}=n_{Fe}+n_M=\dfrac{2,479}{24,79}=0,1\left(mol\right)\left(2\right)\)
- Cho pư với Cl2:
PT: \(2Fe+3Cl_2\underrightarrow{t^o}2FeCl_3\)
\(M+Cl_2\underrightarrow{t^o}MCl_2\)
Theo PT: \(n_{Cl_2}=\dfrac{3}{2}n_{Fe}+n_M=\dfrac{6,1975}{24,79}=0,25\left(mol\right)\left(3\right)\)
Từ (2) và (3) ⇒ nM = -0,2 → vô lý
→ M không pư với dd HCl.
⇒ nFe = nH2 = 0,1 (mol)
Thay vào (3) ⇒ nM = 0,1 (mol)
Thay vào (1) ⇒ MM = 64 (g/mol)
→ M là Cu.
Hòa tan 4g hỗn hợp kim loại A, B, A có hóa trị II, B có hóa trị III bằng 1 lượng HC; vừa đủ thoát ra 3,808l(đktc)
a) Khối lượng muối thu được
b) Nếu biết kim loại 3 là Nhôm và số mol Nhôm trong hỗn hợp bằng 5 lần số mol kim loại có hóa trị II xác định tên kim loại có hóa trị II
a)
\(n_{H_2} = \dfrac{3,808}{22,4} = 0,17(mol)\\ \Rightarrow n_{HCl} = 2n_{H_2} = 0,17.2 = 0,34(mol)\)
Bảo toàn khối lượng :
\(m_{muối} = m_{kim\ loại} + m_{HCl} - m_{H_2} = 4 + 0,34.36,5 - 0,17.2 = 16,07(gam)\)
b)
\(n_A = a(mol) \Rightarrow n_{Al} =5a(mol)\\ A + 2HCl \to 2ACl_2 + H_2\\ 2Al + 6HCl \to 2AlCl_3 + H_2\\ n_{H_2} = n_A + \dfrac{3}{2}n_{Al} = a + \dfrac{3}{2}.5a = 0,17\\ \Rightarrow a = 0,02\\ m_{hỗn\ hợp} = 0,02A + 0,02.5.27 = 4\\ \Rightarrow A = 65(Zn)\)
Vậy kim loại hóa trị II cần tìm là Kẽm.
Hòa tan hết hh X gồm oxit của một kim loại hóa trị II và muối cacbonat của kim loại đó H2SO4 loãng cừa đủ, sau PỨ thu được sản phẩm gồm khí Y và dd Z. Biết lượng khí Y bằng 44% lượng X. Đem cô cạn dd Z thu được một lượng muối khan bằng 168% lượng X. Tìm kim loại hóa trị II. Tính % theo khối lượng mỗi chất trong hh X.
Ta có: MO + H2SO4 ---> MSO4 + H2O
a a
MCO3 + H2SO4 ---> MSO4 + H2O + CO2
b b b
Chọn b=1 => khối lượng CO2 = 44g => mA = 100g => mMSO4 = 168g
(M + 16)a + (M + 60)b = 100 (1)
(M + 96)(a + b) = 168 (2)
Thế b=1 vào (1) và (2) => a = 0,4 mol ; M = 24 (kim loại Mg)
%MO = (40*0,4/100)*100= 16%
%MCO3 = 100% -16% = 84%
Vậy kim loại 2 là mg và khối lượng hóa học x là 84 %