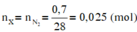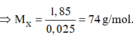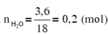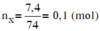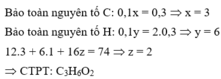Đốt cháy hoàn toàn 4,6 gam chất hữu có A thu được 4,48 lít C O 2 (đktc) và 5,4 gam H 2 O . d A / k k = 1,58. Xác định CTPT của A?
A. C 2 H 4 O
B. C 2 H 6 O
C. C 3 H 8 O
D. C 4 H 10 O
Đốt cháy hoàn toàn 4,6 gam chất hữu cơ Z (chứa C, H, O), sau phản ứng thu được 4,48 lít khí CO2 và 5,4 gam H2O. Biết Mz = 46. Công thức phân tử của X là :
Bảo toàn C và H: \(n_C=n_{CO_2}=0,2(mol);n_H=2n_{H_2O}=0,6(mol)\)
Do đó \(m_O=4,6-0,2.12-0,6.1=1,6(g)\Rightarrow n_O=0,1(mol)\)
Đặt \(CTPT_Z:C_xH_yO_z\)
\(\Rightarrow x:y:z=0,2:0,6:0,1=2:6:1\\ \Rightarrow CTPT_Z:C_2H_6O\)
Đốt cháy hoàn toàn m gam hợp chất hữu cơ X ( C, H, O ). Cần vừa đủ 6,72 lít O 2 (đktc), thu được 4,48 lít CO 2 (đktc) và 5,4 gam H 2 O . Thành phần phần trăm khối lượng oxi trong X là
A. 34,78%
B. 69,56 %
C. 76,19 %
D. 67,71%
Đốt cháy hoàn toàn 4,6 gam một chất hữu cơ X, sau phản ứng thu được 4,48 lít CO2 (đktc) và 5,4 gam H2O. Công thức đơn giản nhất (CTĐGN) của X là:
A. C2H6.
B. CH3.
C. C2H6O.
D. CH3O.
Đáp án C
,nC = nCO2 = 0,2 mol ; nH = 2nH2O = 0,6 mol
Có : mX = mC + mH + mO => nO = 0,1 mol
=> nC : nH : nO = 0,2 : 0,6 : 0,1 = 2 : 6 : 1
Vậy CTĐG nhất là C2H6O
Đốt cháy hoàn toàn m gam hợp chất hữu cơ X ( C, H, O ). Cần vừa đủ 7,84 lít O 2 (đktc), thu được 6,72 lít CO 2 (đktc) và 5,4 gam H 2 O . Thành phần phần trăm khối lượng oxi trong X là
A. 16,62%
B. 45,95%
C. 28,85 %
D. 43,24%.
Đốt cháy hoàn toàn 6 gam chất hữu cơ Y chứa các nguyên tố: C, H, O thu được 4,48 lít C O 2 (đktc) và 3,6 gam H 2 O . Công thức phân tử của Y là
A . C 2 H 6 O
B. C 3 H 8 O
C. C 2 H 4 O 2
D. C 4 H 10 O
Đốt cháy hoàn toàn 4,4 gam hợp chất hữu cơ X (C, H, O). Thu được 4,48 lít CO 2 (đktc) và 3,6 gam H 2 O . Biết tỉ khối của X so với CO 2 bằng 2. Công thức phân tử của X là
A. C 5 H 12 O
B. C 2 H 4 O
C. C 3 H 4 O 3
D. C 4 H 8 O 2
đốt cháy hoàn toàn 6,00 gam một hợp chất hữu cơ A (chứa C,O,H) thu được 4,48 lít CO2 (đktc) và 3,6 gam H2O. Tính tỉ khối hơi của A so với hidro là 30. Lập công thức của A
$M_A = 30.2 =60(g/mol)$
$n_{CO_2} = \dfrac{4,48}{22,4} = 0,2(mol)$
$n_{H_2O} = \dfrac{3,6}{18} = 0,2(mol)$
Bảo toàn nguyên tố C,H :
$n_C = n_{CO_2} = 0,2(mol) ; n_H =2 n_{H_2O} = 0,4(mol)$
$\Rightarrow n_O = \dfrac{6 - 0,2.12 - 0,4}{16} = 0,2(mol)$
$n_C: n_H : n_O = 0,2 : 0,4 : 0,2 = 1 : 2 : 1$
Suy ra : CT của A là $(CH_2O)_n$
$M_A = 30n = 60 \Rightarrow n =2 $
Vậy CT của A là $C_2H_4O_2$
Ta có: \(\left\{{}\begin{matrix}n_{CO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}n_C=0,2mol\\n_H=0,6mol\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_C=0,2\cdot12=2,4\left(g\right)\\m_H=0,6\cdot1=0,6\left(g\right)\end{matrix}\right.\)
Ta thấy: \(m_C+m_H< m_A\) \(\Rightarrow\) Trong A có Oxi
\(\Rightarrow m_O=1,6\left(g\right)\) \(\Rightarrow n_O=\dfrac{1,6}{16}=0,1\left(mol\right)\)
Xét tỉ lệ: \(C:H:O=0,2:0,6:0,1=2:6:1\)
\(\Rightarrow\) Công thức đơn giản nhất là: C2H6O
\(\Rightarrow\) Công thức phân tử: (C2H6O)n
Mà \(M_A=2,875\cdot16=46\)
\(\Rightarrow n=1\)
Vậy công thức phân tử và công thức đơn giản nhất cần tìm là C2H6O
nH2=5,4: 18 x 2=0,6
nC= 4,48 : 22,4=0,2
mO=0,6+ 0,2 x12=1,6 ----> nO= 1,6 : 16=0,1
công thức phân tử: CxHyOz là C2H6O
ok nha bạn :))
\(n_C = n_{CO_2} = \dfrac{4,48}{22,4} = 0,2(mol)\\ n_H = 2n_{H_2O} = 2.\dfrac{5,4}{18} = 0,6(mol)\\ \Rightarrow n_O = \dfrac{m_A - m_C-m_H}{16} = \dfrac{4,6-0,2.12-0,6.1}{16} = 0,1(mol)\)
Ta có :
\(n_A = \dfrac{4,6}{2,875.16} = 0,1(mol)\)
Số nguyên tử C : \(\dfrac{n_C}{n_A} = \dfrac{0,2}{0,1} = 2\)
Số nguyên tử H : \(\dfrac{n_H}{n_A} = \dfrac{0,6}{0,1} = 6\)
Số nguyên tử O : \(\dfrac{n_O}{n_A} = \dfrac{0,1}{0,1} = 1\)
Vậy CTPT cần tìm : \(C_2H_6O\)
Đốt cháy hoàn toàn 7,4 gam hợp chất hữu cơ X ( C, H, O ). Thu được 6,72 lít CO 2 (đktc) và 5,4 gam H 2 O . Khi hóa hơi 1,85 gam X, thu được thể tích bằng với thể tích của 0,7 gam N 2 cùng nhiệt độ, áp suất. Xác định công thức phân tử của X
A. C 5 H 10 O
B. C 3 H 6 O 2
C. C 2 H 2 O 3
D. C 3 H 6 O
Đáp án B
Đặt CTPT của X là CxHyOz
Do ở cùng điều kiện nhiệt độ và áp suất thì tỉ lệ về thể tích cũng chính là tỉ lệ về số mol.