Cho 1,38 gam KL kiềm tác dụng với H2O dư thu được 0,672 lit H2 (đktc). Xác định tên KL
HN
Những câu hỏi liên quan
Cho 10 gam KL kiềm thổ tác dụng với H2O dư thu được 5,6 lit H2 (đktc). Xác định tên KL
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2X + 2nH2O → 2XOHn + nH2
Mol: \(\dfrac{0,5}{n}\) 0,25
\(\Rightarrow M_X=\dfrac{10}{\dfrac{0,5}{n}}=20n\left(g/mol\right)\)
Vì X là kim loại nên có hóa trị l,ll,lll
| n | l | ll | lll |
| Mx | 20 | 40 | 60 |
| Kết luận | loại | thỏa mãn | loại |
⇒ X là canxi (Ca)
Đúng 1
Bình luận (0)
Cho 0,3 gam hỗn hợp KL X và Y ở 2 chu kì kế tiếp nhau của nhóm IA tác dụng với H2O dư thu được 0,224 lit H2(đktc). Xác định tên 2 KL kiềm.
Gọi 2 kim loại kiềm của nhóm IA là M
n h2 = 0,224: 22,4=0,01 mol
M + 2H2O -> 2MOH + H2
n M = 0,3/ M M = n H2 = 0,01
=> M M = 30 đvc
mà M là 2 kim loại kiềm thuộc chu kì liên tiếp
=> M gồm Li và Na
Đúng 1
Bình luận (0)
xin lỗi mk làm nhầm
gọi 2 kl kiềm của nhóm IA là R
n H2 = 0,224:22,4=0,01 mol
n R = 0,3/ M R mol
2R + 2H2O -> 2ROH +H2
=> nR = n H2 .2
=> 0,3/M R = 0,02
=> M R =15 đvc
ko có gt nào tm
Đúng 0
Bình luận (0)
Cho 11,04 gam KL kiềm tác dụng với H2O dư thu được 0,48 gam H2. Xác định tên KL
Gọi kim loại kiềm là R.
PTHH: 2R + 2xH2O ---> 2R(OH)x + xH2
Ta có: \(n_{H_2}=\dfrac{0,48}{2}=0,24\left(mol\right)\)
Theo PT: \(n_R=\dfrac{2}{x}.n_{H_2}=\dfrac{2}{x}.0,24=\dfrac{0,48}{x}\left(mol\right)\)
=> \(M_R=\dfrac{11,04}{\dfrac{0,48}{x}}=\dfrac{11,04x}{0,48}=23x\left(g\right)\)
Biện luận:
| x | 1 | 2 | 3 |
| M | 23 | 46 | 69 |
| Na | loại | loại |
Vậy kim loại kiềm là natri (Na)
Đúng 1
Bình luận (1)
Cho 3,9 gam một kim loại kiềm tác dụng với H2O dư thu được 1,12 lit H2 (đktc).Xác định tên kim loại đó.
Hãy xác định ô nguyên tố, chu kì, nhóm; Công thức hợp chất khí với hiđro (nếu có), Công thức oxit, hiđroxit cao nhất, hiđroxit cao nhất có tính chất gì?
khi cho 10 gam 1 kim loại nhóm IIA tác dụng hết 200 gam nước thu được 5,6 lit khí (đktc) và dd A. Xác định tên kl và nồng độ % dd A thu được ?
\(KL:A\left(II\right)\\ n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\\ A+2H_2O\rightarrow A\left(OH\right)_2+H_2\\ n_A=n_{AOH}=n_{H_2}=0,25\left(mol\right)\\ \Rightarrow M_A=\dfrac{10}{0,25}=40\left(\dfrac{g}{mol}\right)\\ \Rightarrow A\left(II\right):Canxi\left(Ca=40\right)\\ m_{Ca\left(OH\right)_2}=74.0,25=18,5\left(g\right)\\ m_{ddCa\left(OH\right)_2}=10+200-0,25.2=209,5\left(g\right)\\ C\%_{ddCa\left(OH\right)_2}=\dfrac{18,5}{209,5}.100\approx8,831\%\)
Đúng 1
Bình luận (0)
Cho 1,38 gam kim loại kiềm X tác dụng hoàn toàn với 78,68 gam H2O , sau phản ứng thu được dung dịch Y có nồng độ chất tan 3%. Xác định tên kim loại X.
Cho 8,0 gam một kim loại kiềm thổ ( hóa trị II) tác dụng với nước dư thu được 4,48 lít khí H2 (đktc). Xác định tên kim loại kiềm thổ trên?
Giúp em với
\(n_{H_2}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(M+2H_2O\rightarrow M\left(OH\right)_2+H_2\)
\(0.2........................................0.2\)
\(M_M=\dfrac{8}{0.2}=40\left(\dfrac{g}{mol}\right)\)
\(M:Ca\left(Canxi\right)\)
Đúng 3
Bình luận (1)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: A + 2H2O --> A(OH)2 + H2
_____0,2<--------------------------0,2
=> \(M_A=\dfrac{8}{0,2}=40\left(g/mol\right)=>Ca\)
Đúng 0
Bình luận (0)
Cho 3,1 g hỗn hợp gồm hai kim loại kiềm ở hai chu kì kế tiếp nhau trong bảng tuần hoàn tác dụng hết với nước thu được 1,12 lít H2 ở đktc và dung dịch kiềm. Xác định tên 2 KL đó và tính thành phần phần trăm khối lượng mỗi kim loại
Gọi công thức chung cho hai kim loại kiềm là M
Số mol H2: nH2 = 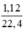 = 0,05(mol)
= 0,05(mol)
PTHH: 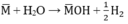
Theo pt: nM = 2. nH2 = 2. 0,05 = 0,1(mol)
⇒ M = 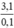 = 31 → Na, K
= 31 → Na, K
Gọi x, y lần lượt là số mol của Na và K trong hỗn hợp
Theo bài ra ta có hệ phương trình:
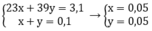
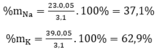
Đúng 1
Bình luận (0)
Cho 11, 7g một KL kiềm tác dụng hoàn toàn với 98,86g H2O. Sau phản ứng thu được dd A và 0,336 litkhi ở đktc.
a) Xác định tên kim loại
b) Tính C% chất có trong dd A%
Bạn xem lại đề nhé, nếu 11,7g kim loại thì không có kim loại thỏa mãn nhé, nesu 1,17g thì tìm đc kim loại K(kali).
Đúng 1
Bình luận (0)







