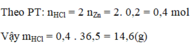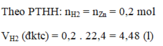cho 13g kẽm tác dụng với axit clohidric theo sơ đồ phản ứng Zn+HCL ===>ZNCL2+H2 a. lập phương trình hóa học của phản ứng b. tính thể tích khí thu được ở đktc c. tính tỉ khối lương axit clohidric cần dùng
LH
Những câu hỏi liên quan
Cho 13g kẽm tác dụng với HCl theo sơ đồ phản ứng
Z n + H C l → Z n C l 2 + H 2
Lập PTHH của phản ứng.
Cho 13g kẽm tác dụng với HCl theo sơ đồ phản ứng
Z n + H C l → Z n C l 2 + H 2
Tính khối lượng HCl đã tham gia phản ứng
Cho 13g kẽm tác dụng với HCl theo sơ đồ phản ứng
Z n + H C l → Z n C l 2 + H 2
Tính thể tích khí H 2 (ĐKTC) đã sinh ra sau phản ứng
Mọi người giúp em với ạ , em xin cảm ơn :3
Cho 0,1mol kim loại Kẽm tác dụng hoàn toàn với dung dịch axit clohidric theo sơ đồ: Zn+Hcl-->ZnCl2 + H2.Vậy sau phản ứng thể tích Hidro thu được ở đktc là bao nhiêu? (biết Zn = 56)
Cho 16.25 gam kẽm phản ứng vừa đủ với dung dịch axit clohidric theo sơ đồ sau Zn + HCL---> Zncl2 +H2 a tính khối lượng dung dịch axit clohidic đã phản ứng b tính thể tích khí sinh ra (đktc)?
a) Số mol kẽm tham gia phản ứng : \(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{16,25}{65}=0,25\left(mol\right)\).
PTHH : \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Mol : 1 : 2 : 1 : 1
Mol : 0,25 → 0,5 → 0,25 → 0,5
Suy ra, số mol dung dịch Axit Clohidric \(HCl\) tham gia phản ứng là \(n_{HCl}=0,5\left(mol\right)\).
Khối lượng dung dịch đã dùng : \(m_{HCl}=n_{HCl}.M_{HCl}=\left(0,5\right).\left(36,5\right)=18,25\left(g\right)\).
b) Từ câu a, suy ra số mol khí Hidro sinh ra là \(n_{H_2}=0,25\left(mol\right)\).
Thể tích khí Hydro sinh ra là : \(V_{H_2}=n_{H_2}.22,4=\left(0,25\right).\left(22,4\right)=5,6\left(l\right)\)
Đúng 1
Bình luận (0)
Lập PTHH của phản ứng giữa HCl tác dụng với kẽm theo sơ đồ sau: Zn + HCl −−→ ZnCl2 + H2
Biết rằng sau phản ứng thu được 0,3 mol khí hydrogen H2. Hãy tính: a) Khối lượng kẽm đã phản ứng
b) Khối lượng axit HCl đã phản ứng
c) Khối lượng ZnCl2 tạo thành.
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
___0,3____0,6_____0,3____0,3 (mol)
a, \(m_{Zn}=0,3.65=19,5\left(g\right)\)
b, \(m_{HCl}=0,6.36,5=21,9\left(g\right)\)
c, \(m_{ZnCl_2}=0,3.136=40,8\left(g\right)\)
Bạn tham khảo nhé!
Đúng 8
Bình luận (0)
Zn+2HCl->ZnCl2+H2
0,3---0,6-----0,3----0,3 mol
=>m Zn=0,3.65=19,5g
=>m HCl=0,6.35,6=21,9g
=>m ZnCl2=0,3.136=40,8g
Đúng 1
Bình luận (3)
Kẽm tác dụng với axit sunfuric theo sơ đồ sau: Zn + HCl → ZnCl2 + H2 Có 13 g kẽm tham gia phản ứng. Tính: a) Khối lượng axit tham gia phản ứng.
b) Khối lượng muối ZnCl2 tạo thành. c) Thể tích khí hidro thu được sau phản ứng (đktc)
$PTHH:Zn+2HCl\to ZnCl_2+H_2\uparrow$
$n_{Zn}=\dfrac{13}{65}=0,2(mol)$
Theo PT: $n_{ZnCl_2}=n_{H_2}=0,2(mol);n_{HCl}=0,4(mol)$
$a)m_{axit}=m_{HCl}=n.M=0,4.36,5=14,6(g)$
$b)m_{ZnCl_2}=n.M=0,2.136=27,2(g)$
$c)V_{H_2(đktc)}=n.22,4=0,2.22,4=4,48(lít)$
Đúng 2
Bình luận (0)
Số mol kẽm là :
\(n=\dfrac{m}{M}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH : Zn + 2HCL -> ZnCl2 + H2
1 2 1 1
0,2 mol -> 0,4 mol 0,2 mol 0,2 mol
a, Khối lượng HCL là :
\(m=n.M=0,4.35,5=14,2\left(g\right)\)
b, Khối lượng ZnCL2 là :
\(m=n.M=0,1.136=13,6\left(g\right)\)
c, Thể tích H2 là : V = n . 22,4 = \(0,1.22,4=2,24\left(l\right)\)
Đúng 2
Bình luận (2)
Kẽm tác dụng với axit clohiđric theo sơ đồ phản ứng sau Zn+HCl--->ZnCl2 +H2 Nếu có 13 gam kem tham gia phản ứng.Em hãy tìm: A/ thể tích khí H2 (ở đktc)? B/khối lượng Axit Clohiđríc đã dùng?
a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Ta có: \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, Theo PT: \(n_{HCl}=2n_{Zn}=0,4\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\)
Đúng 1
Bình luận (0)
Cho 32,5g bột kẽm Zn tác dụng vừa đủ với dung dịch axit Clohiđric theo sơ đồ phản ứng sau : Zn +HCl ---> ZnCl2+H2 Hãy tính : a thể tích khí hiđro thu được ở đktc b khối lượng axit Clohiđric cần dùng
PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
+\(n_{Zn}=\dfrac{32,5}{65}=0,5\left(mol\right)\)
+\(nH_2=n_{Zn}=0,5\left(mol\right)\)
+\(n_{HCl}=2n_{Zn}=1\left(mol\right)\)
+\(V_{H2}=0,5.22,4=11,2\left(lit\right)\)
\(m_{HCl}=1.36,5=36,5\left(gam\right)\)
Đúng 2
Bình luận (0)
\(n_{Zn}=\dfrac{m}{M}=\dfrac{32,5}{65}=0,5\left(mol\right)\)
\(Zn\) \(+\) \(2\)\(HCl\) → \(ZnCl_2\) \(+\) \(H_2\)
\(0,5\) \(mol\) → \(1\) \(mol\) → \(0,5\)\(mol\) → \(0,5\) \(mol\)
\(V_{H_2}=n.22,4=0,5.22,4=11,2\left(l\right)\)
\(m_{HCl}=n.M=1.36,5=36,4\left(g\right)\)
Đúng 1
Bình luận (0)