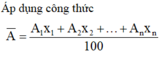Tính nguyên tử khối trung bình của nguyên tố Oxi, biết Oxi có 3 đồng vị : 99,757% 816O; 0,039% 817O; 0,204% 818O .
LT
Những câu hỏi liên quan
Câu 4. Nguyên tố oxi có 3 đồng vị 16O chiếm 99,757% ; 17O chiếm 0,039%; 18O chiếm 0,204%. Nguyên tử khối trung bình của oxi :
A. 16,000 B. 16,012 C. 16,023 D. 16,004
\(\overline{M}=\dfrac{99,757.16+0,039.17+0,204.18}{100}=16,004\left(g/mol\right)\)
=> D
Đúng 1
Bình luận (0)
tính khối lượng nguyên tử trung bình của các nguyên tố sau đây
a/ Bo có 2 đồng vị: 10B(18,89%)và11B(81,11%)
b/ Oxi có 3 đồng vị:16 8 O(99,757%); 17 8 O(0,039%); 18 8 O(0,204%)
\(a.\overline{NTK}_B=\dfrac{10.18,89\%+11.81,11\%}{100\%}=10,8111\left(đ.v.C\right)\\ b.\overline{NTK}_O=\dfrac{16.99,757\%+17.0,039\%+18.0,204\%}{100\%}=16,00447\left(đ.v.C\right)\)
Đúng 1
Bình luận (0)
Oxi có 3 đồng vị với hàm lượng phần trăm số nguyên tử tương ứng cho như bảng dưới
Đồng vị
O
8
16
O
8
17
O
8
18...
Đọc tiếp
Oxi có 3 đồng vị với hàm lượng phần trăm số nguyên tử tương ứng cho như bảng dưới
| Đồng vị |
O
8
16
|
O
8
17
|
O
8
18
|
| % |
99,757% |
0,038% |
0,205% |
Nguyên tử khối trung bình của Oxi bằng
A. 16,00436
B. 15,99938
C. 16,00448
D. 15,99925
Đáp án C
Áp dụng công thức A ¯ = A 1 x 1 + A 2 x 2 + . . . + A n x n 100 ta có:
Đúng 0
Bình luận (0)
trong tự nhiên nguyên tố oxi tồn tại 3 đồng vị bền trong đó 16O chiếm 99,76%, 17O chiếm 0,039%, 18O chiếm 0,201%. tính nguyên tử khối trung bình của oxi
\(\overline{M}_O=\dfrac{16.99,76+17.0,039+18.0,201}{100}=16\left(g/mol\right)\)
Đúng 1
Bình luận (0)
Oxi tự nhiên là một hỗn hợp các đồng vị: 99,757% 16O; 0,039% 17O; 0,204% 18O. Tính số nguyên tử của mỗi loại đồng vị khi có 1 nguyên tử 17O
Khi có 1 nguyên tử 17O, mà % nguyên tử của 17O = 0,039%
⇒ Số nguyên tử O = 1 : 0,039% = 2564 nguyên tử
99,757% 16O ⇒ Số nguyên tử 16O = 99,757%.2564 = 2558 nguyên tử
0,204% 18O ⇒ Số nguyên tử 18O = 0,204%.2564 = 5 nguyên tử
Đúng 0
Bình luận (0)
Oxi có 3 đồng vị với hàm lượng phần trăm số nguyên tử tương ứng cho như bảng dưới. Nguyên tử khối trung bình của Oxi bằng A. 16,00436 B. 15,99938 C. 16,00448 D. 15,99925
Đọc tiếp
Oxi có 3 đồng vị với hàm lượng phần trăm số nguyên tử tương ứng cho như bảng dưới.
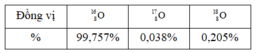
Nguyên tử khối trung bình của Oxi bằng
A. 16,00436
B. 15,99938
C. 16,00448
D. 15,99925
Oxi tự nhiên là một hỗn hợp các đồng vị: 99,757% 16O; 0,039% 17O; 0,204% 18O. Tính số nguyên tử của mỗi loại đồng vị khi có 1 nguyên tử 17O
Tại sao lại lấy 1/0,039% vậy ạ
Vì 1 ntử 17O chiếm 0,039% nên lấy 1/0,039% để tính tổng các ntử của các đồng vị khác
Đúng 0
Bình luận (0)
Oxi có 3 đồng vị 16O,17O,18O.Biết % các đồng vị tương ứng là x1,x2,x3 trong đó x1=15x2,x2=21x3,Khối lượng nguyên tử trung bình của oxi là
oxi tự nhiên là một hỗn hợp của các đồng vị : 99,757% 16O ; 0,039% 17O ; 0,204% 18O . Tính số nguyên tử của mỗi loại đồng vị khi có một nguyên tử 17O
HD:
Số nguyên tử của 16O là 99,757/0,039 = 2558 nguyên tử, số nguyên tử 18O là 0,204/0,039 = 5 nguyên tử
Đúng 0
Bình luận (0)