vai trò của ion H+ và ion OH - trong phản ứng dung dịch đất
giúp mình với ạ !!
cho đồ thị biểu diễn mối liên hệ giữa lượng ion H+ và lượng kết tủa Al(OH)3 trong phản ứng của dung dịch chưa ion H+ với dung dịch chứa ion [Al(OH)4]- hoặc ion AlO2- như sau

Với X là nồng độ mol/l của dung dịch HCl. Khối lượng kết tủa trong 2 trường hợp đều là a (gam). Dựa vào đồ thị, giá trị của a là
A. 0,468.
B. 1,95
C. 0,78
D. 0,936
Cho các cặp ion sau trong dung dịch: (1) H+ và HCO3-, (2) AlO2- và OH-, (3) Mg2+ và OH-, (4) Ca2+ và HCO3-, (5) OH- và Zn2+, (6) K+ + NO3-, (7) Na+ và HS-, (8) H+ + AlO2-. Những cặp ion nào phản ứng được với nhau
A. (1), (2), (4), (7).
B. (1), (2), (3), (8).
C. (1), (3), (5), (8).
D. (2), (3), (6),(7).
Dung dịch X có chứa các ion: K+, NH4+, HCO3-, HSO3-, SO32- và Cl-. Viết phương trình phản ứng xảy ra dưới dạng ion khi a) cho dung dịch X tác dụng với dung dịch BaCl2 b) cho dung dịch X tác dụng với dung dịch Ba(OH)2 Giúp e câu này với
Cho dung dịch B a ( O H ) 2 đến dư vào 75 ml dung dịch muối amoni sunfat.
1. Viết phương trình hoá học của phản ứng dưới dạng ion.
2. Tính nồng độ mol của các ion trong dung dịch muối ban đầu, biết rằng phản ứng tạo ra 17,475 g một chất kết tủa. Bỏ qua sự thuỷ phân của ion amoni trong dung dịch.
1. 2 N H 4 + + S O 4 2 - + B a 2 + + 2 O H - → B a S O 4 ↓ + 2 N H 3 ↑ + 2 H 2 O
2. Số mol B a S O 4 : 17,475/233 = 0,075(mol)
Theo phản ứng, vì lấy dư dung dịch B a ( O H ) 2 nên S O 4 2 - chuyển hết vào kết tủa B a S O 4 và N H 4 + chuyển thành N H 3 . Do đó :
n S O 4 2 - = n B a S O 4 = 0,075 mol ;
n N H 4 + = 2. n S O 4 2 - = 2. 0,075 = 0,15 (mol).
Nồng độ mol của các ion N H 4 + và S O 4 2 - trong 75 ml dung dịch muối amoni sunfat :
[ N H 4 + ] = 2 (mol/l)
[ S O 4 2 - ] = 1 (mol/l)
Viết phương trình hoá học (dưới dạng phân tử và ion rút gọn) của phản ứng trao đổi ion trong dung dịch tạo thành từng chất kết tủa sau:Cr(OH)3 ; Al(OH)3; Ni(OH)2
CrCl3 + 3NaOH (đủ) → Cr(OH)3 ↓ + 3 NaCl
Cr3+ + 3OH- → Cr(OH)3 ↓
AlCl3 + 3NaOH (đủ) Al(OH)3 ↓ + 3 NaCl
Al3+ + 3OH- → Al(OH)3 ↓
Hoặc AlCl3 + 3NH3 (dư) + 3H2O → Al(OH)3 ↓ + 3NH4Cl
Al3+ + 3NH3 (dư) + 3H2O → Al(OH)3 ↓ + 3NH4+
Ni(NO3)2 + 2NaOH → Ni(OH)2 ↓ + 2NaNO3
Ni2+ + 2OH- → Ni(OH)2 ↓
Cho đồ thị biểu diễn mối liên hệ giữa lượng ion H + và lượng kết tủa Al OH 3 trong phản ứng của dung dịch chứa ion H + với dung dịch chứa ion AlO 2 - như sau :
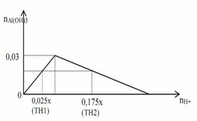
Với x là nồng độ mol/l của dung dịch HCl. Khối lượng kết tủa trong 2 trường hợp đều là a (gam). Dựa vào đồ thị, giá trị của a là
A. 0,780
B. 0,936
C. 1,950
D. 0,468
Trong phản ứng nhiệt phân muối NH4NO2 và NH4NO3, số oxi hóa của nitơ biến đổi như thế nào? Nguyên tử nitơ trong ion nào của muối đóng vai trò chất khử và nguyên tử nitơ trong ion nào của muối đóng vai trò chất oxi hóa?
Cả hai phản ứng trên, số oxi hóa của nito đều không đổi ( đều là phản ứng oxit hóa nội phân tử)
Trong hai phản ứng :
$NH_4^+$ đều là chất khử ( số hóa oxi hóa của N tăng từ -3 lên 0)
$NO_3^- , NO_3^-$ đều là chất oxi hóa ( số oxi hóa của N lần lượt giảm từ +3 xuống 0 và giảm từ +5 xuống +1)
Trong phản ứng nhiệt phân các muối NH4NO2 và NH4NO3 số oxi hoá của nitơ biến đổi như thế nào? Nguyên tử nitơ trong ion nào của muối đóng vai trò chất khử và nguyên tử nitơ trong ion nào của muối đóng vai trò chất oxi hoá?
Phản ứng nhiệt phân:
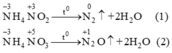
Trong hai phản ứng trên số oxi hoá của nitơ trong mỗi phản ứng đều thay đổi. Trong mỗi phân tử muối một nguyên tử nitơ có số oxi hoá tăng, một nguyên tử có số oxi hoá giảm, đây là phản ứng oxi hoá khử nội phân tử.Ở cả hai phản ứng nitơ nguyên tử trong ion NH+4 đều là chất khử (chất cho e) nitơ từ số oxi hoá -3 tăng lên 0 ở phản ứng (1) và lên +1 ở phản ứng (2).Nguyên tử nitơ trong ion NO2- và NO3- là chất oxi hoá (chất nhận e). Ở phản ứng (1) số oxi hoá của N từ +3 (trong NO2- ) xuống 0 và ở phản ứng (2) số oxi hoá của nitơ từ +5 (trong NO3-) xuống +1.
Giải giúp mình 2 câu nhé:
1) Tính nồng độ mol/lit của các ion trong dung dịch
a)Ion K+ và SO4 2- trong dung dịch K2SO4 0,05M
b)Ion Ba 2+ và OH- trong dung dịch Ba(OH)2 0,02M
c)Ion H+ và NO3 - trong 100ml dung dịch HNO3 nồng độ 10% (D=1,054g/ml)
2) Cho 150 ml dung dịch KOH 2M vào 250ml dung dịch HCl 3M. Tính nông độ mol/lit của các ion trong dung dịch sau phản ứng
2)
nKOH = 0.15*2=0.3 mol
nHCl = 0.25*3=0.75 mol
KOH + HCl --> KCl + H2O
Bđ: 0.3____0.45
Pư : 0.3____0.3____0.3
Kt: 0______0.15___0.3
DD sau phản ứng : 0.15 mol HCl dư , 0.3 mol KCl
CM H+= 0.15/0.25=0.6M
CM Cl- = 0.15/0.25=0.6 M
CM K+= 0.3/(0.15+0.25)=0.75M
CM Cl-= 0.3/(0.15+0.25)= 0.75M