Câu 2: Viết 4 phương trình điều chế khí \(SO_2\)
LN
Những câu hỏi liên quan
Câu 1: Từ P, hãy điều chế H3PO4.Câu 2: Từ S, hãy điều chế H2SO4.Câu 3: Từ quặng pirit sắt (FeS2), O2, H2O và các chất xúc tác thích hợp, hãy viết phương trình điều chế Fe2(SO4)3.Câu 4: Viết phương trình điều chế các chất sau đây bằng 2 phương pháp khác nhau:a) CuO b) MgO c) SO2 d) CO2Câu 5: Từ các chất sau: BaO, H2O, H2SO4, CuO, hãy viết phương trình điều chế Ba(OH)2, BaSO4, CuSO4.Câu 6: Từ các chất sau:...
Đọc tiếp
Câu 1: Từ P, hãy điều chế H3PO4.
Câu 2: Từ S, hãy điều chế H2SO4.
Câu 3: Từ quặng pirit sắt (FeS2), O2, H2O và các chất xúc tác thích hợp, hãy viết phương trình điều chế Fe2(SO4)3.
Câu 4: Viết phương trình điều chế các chất sau đây bằng 2 phương pháp khác nhau:
a) CuO b) MgO c) SO2 d) CO2
Câu 5: Từ các chất sau: BaO, H2O, H2SO4, CuO, hãy viết phương trình điều chế Ba(OH)2, BaSO4, CuSO4.
Câu 6: Từ các chất sau: Zn, H2SO4, H2O, Ca, hãy viết phương trình điều chế Ca(OH)2, Zn(OH)2.
Câu 7: Từ Zn, S, H2O, O2. Hãy viết phương trình điều chế ra 2 oxit, 2 axit, 2 muối.
Câu 8: Từ Ca, S, O2, hãy viết phương trình điều chế CaSO4.
Câu 9: Viết phương trình điều chế ZnCl2 từ chất ban đầu sau:
a) Zn b) ZnO c) ZnSO4
Câu 10: Viết phương trình điều chế NaNO3 từ chất ban đầu sau:
a) NaOH b) NaCl c) Na2CO3
Câu 3: Từ quặng pirit sắt (FeS2), O2, H2O và các chất xúc tác thích hợp, hãy viết phương trình điều chế Fe2(SO4)3.Câu 4: Viết phương trình điều chế các chất sau đây bằng 2 phương pháp khác nhau:a) CuO b) MgO c) SO2 d) CO2Câu 5: Từ các chất sau: BaO, H2O, H2SO4, CuO, hãy viết phương trình điều chế Ba(OH)2, BaSO4, CuSO4.Câu 6: Từ các chất sau: Zn, H2SO4, H2O, Ca, hãy viết phương trình điều chế Ca(OH)2, Zn(...
Đọc tiếp
Câu 3: Từ quặng pirit sắt (FeS2), O2, H2O và các chất xúc tác thích hợp, hãy viết phương trình điều chế Fe2(SO4)3.
Câu 4: Viết phương trình điều chế các chất sau đây bằng 2 phương pháp khác nhau:
a) CuO b) MgO c) SO2 d) CO2
Câu 5: Từ các chất sau: BaO, H2O, H2SO4, CuO, hãy viết phương trình điều chế Ba(OH)2, BaSO4, CuSO4.
Câu 6: Từ các chất sau: Zn, H2SO4, H2O, Ca, hãy viết phương trình điều chế Ca(OH)2, Zn(OH)2.
Câu 7: Từ Zn, S, H2O, O2. Hãy viết phương trình điều chế ra 2 oxit, 2 axit, 2 muối.
Câu 8: Từ Ca, S, O2, hãy viết phương trình điều chế CaSO4.
Câu 9: Viết phương trình điều chế ZnCl2 từ chất ban đầu sau:
a) Zn b) ZnO c) ZnSO4
Câu 10: Viết phương trình điều chế NaNO3 từ chất ban đầu sau:
a) NaOH b) NaCl c) Na2CO3
Câu 4 :
\(a.\)
\(Cu\left(OH\right)_2\underrightarrow{^{^{t^0}}}CuO+H_2O\)
\(Cu+\dfrac{1}{2}O_2\underrightarrow{^{^{t^0}}}CuO\)
\(b.\)
\(Mg\left(OH\right)_2\underrightarrow{^{^{t^0}}}MgO+H_2O\)
\(Mg+\dfrac{1}{2}O_2\underrightarrow{^{^{t^0}}}MgO\)
\(c.\)
\(S+O_2\underrightarrow{^{^{t^0}}}SO_2\)
\(Na_2SO_3+2HCl\rightarrow2NaCl+SO_2+H_2O\)
\(d.\)
\(C+O_2\underrightarrow{^{^{t^0}}}CO_2\)
\(Na_2CO_3+2HCl\rightarrow2NaCl+CO_2+H_2O\)
Câu 5 :
\(BaO+H_2O\rightarrow Ba\left(OH\right)_2\)
\(BaO+H_2SO_4\rightarrow BaSO_4+H_2O\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
Đúng 2
Bình luận (0)
Câu 3 :
$4FeS_2 + 11O_2 \xrightarrow{t^o} 2Fe_2O_3 + 8SO_2$
$2SO_2 + O_2 \xrightarrow{t^o,xt} 2SO_3$
$SO_3 + H_2O \to H_2SO_4$
$Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O$
Câu 4 :
a)
$2Cu + O_2 \xrightarrow{t^o} 2CuO$
$Cu(OH)_2 \to CuO + H_2O$
b)
$2Mg + O_2 \xrightarrow{t^o} 2MgO$
$Mg(OH)_2 \xrightarrow{t^o} MgO + H_2O$
c)
$S + O_2 \xrightarrow{t^o} SO_2$
$Na_2SO_3 + 2HCl \to 2NaCl + SO_2 + H_2O$
d)
$C + O_2 \xrightarrow{t^o} CO_2$
$Na_2CO_3 + 2HCl \to 2NaCl + CO_2 + H_2O$
Đúng 2
Bình luận (0)
Câu 8 :
$S + O_2 \xrightarrow{t^o} SO_2$
$2SO_2 + O_2 \xrightarrow{t^o} 2SO_3$
$SO_3 + H_2O \to H_2SO_4 $
$Ca + H_2SO_4 \to CaSO_4 + H_2$
Câu 9 :
$a) Zn + Cl_2 \xrightarrow{t^o} ZnCl_2$
$b) 2Zn + O_2 \xrightarrow{t^o} 2ZnO$
$c) Zn + H_2SO_4 \to ZnSO_4 + H_2$
Đúng 2
Bình luận (0)
Xem thêm câu trả lời
Để điều chế SO2 người ta đốt cháy 120kg FeS2 trong không khí. Tính khối lượng \(SO_2\) , biết hiệu suất quá trình là 80%
$4FeS_2 + 11O_2 \xrightarrow{t^o}2Fe_2O_3 + 8SO_2$
$n_{FeS_2} = \dfrac{120}{120} = 1(kmol)$
$n_{FeS_2\ pư} = 1.80\% = 0,8(kmol)$
$n_{SO_2} = 2n_{FeS_2\ pư} = 1,6(kmol)$
$m_{SO_2} = 1,6.64 = 102,4(kg)$
Đúng 4
Bình luận (2)
2FeS2+11\2O2-to>4SO2+Fe2O3
1----------------------------2 kmol
n FeS2=120\120=1 k mol
H=80%
=>m SO2=2.64.80\100=102,4kg
Đúng 2
Bình luận (0)
câu 9 : trong phòng thí nghiệm điều chế khí oxi bằng cách nhiệt phân muối kaliclorat
a) viết phương trình phản ứng
b) muốn điều chế 4,48 gam khí oxi (đktc) cần dùng bao nhiêu gam KCLO3 sau phản ứng thu được bao nhiêu gam chất rắn
a) 2KClO3 (7/75 mol) \(\underrightarrow{t^o}\) 2KCl (7/75 mol) + 3O2\(\uparrow\) (0,14 mol).
b) Số mol khí oxi là 4,48/32=0,14 (mol).
Khối lượng kali clorat cần dùng là 7/75.122,5=343/30 (g).
Khối lượng chất rắn thu được là 7/75.74,5=1043/150 (g).
Đúng 1
Bình luận (0)
\(a,PTHH:2KClO_3\underrightarrow{t^o,MnO_2}2KCl+3O_2\uparrow\\ b,n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ Theo.pt:n_{KClO_3}=\dfrac{2}{3}n_{O_2}=\dfrac{2}{3}.0,2=\dfrac{2}{15}\left(mol\right)\\ m_{KClO_3}=\dfrac{2}{15}.122,5=\dfrac{49}{3}\left(g\right)\)
Đúng 3
Bình luận (0)
Câu 1. Trình bày tính chất vật lý, ứng dụng, tính chất hóa học của Oxi và viết PTHH minh họa.Câu 2. Trình bày phương pháp điều chế (nguyên tắc, PTHH) và thu khí oxi trong PTN.Câu 3. Cho biết công thức tổng quát, phân loại và cách gọi tên Oxit.Câu 4. Trình bày tính chất vật lý, ứng dụng, tính chất hóa học của hiđro và viết PTHH minh họa.Câu 5. Trình bày phương pháp điều chế (nguyên tắc, PTHH) và thu khí hidro trong PTN.Câu 6. Thế nào là phản ứng phân hủy? Phản ứng hóa hợp? Phản ứng thế? Viết phươ...
Đọc tiếp
Câu 1. Trình bày tính chất vật lý, ứng dụng, tính chất hóa học của Oxi và viết PTHH minh họa.
Câu 2. Trình bày phương pháp điều chế (nguyên tắc, PTHH) và thu khí oxi trong PTN.
Câu 3. Cho biết công thức tổng quát, phân loại và cách gọi tên Oxit.
Câu 4. Trình bày tính chất vật lý, ứng dụng, tính chất hóa học của hiđro và viết PTHH minh họa.
Câu 5. Trình bày phương pháp điều chế (nguyên tắc, PTHH) và thu khí hidro trong PTN.
Câu 6. Thế nào là phản ứng phân hủy? Phản ứng hóa hợp? Phản ứng thế? Viết phương trình hóa học minh họa.
Câu 1 tính chất vật lý : ko màu ko mù vị , ít tan trong nước , nặng hơn kk
. hóa lỏng ở -183oC có màu xanh nhạt
tính chất hóa học : rất hoát động ở nhiệt độ cao . có thể tác dụng với phi kim , kim loại và hợp chất
VD :td với phi kim S+O2 -t--> SO2
VD :td với kim loại 3Fe+ 2O2 -t---> Fe3O4
bài 2 :
- thu khí O2 ở bằng cách đun nóng nhuengx hợp chất giàu O2 và dễ bị phân hủy như KMnO4 . KClO3
pthh : 2KMnO4 --t--> K2MnO4 + MnO2 + O2
- thu khí oxi bằng cách đẩy kk và đẩy nước
bài 3
dạng tổng quát : M2Ox ( M là đơn chất )
- cách gọi tên : tên nguyên tố +oxit
Đúng 3
Bình luận (0)
Câu 1 tính chất vật lý : ko màu ko mù vị , ít tan trong nước , nặng hơn kk
. hóa lỏng ở -183oC có màu xanh nhạt
tính chất hóa học : rất hoát động ở nhiệt độ cao . có thể tác dụng với phi kim , kim loại và hợp chất
VD :td với phi kim S+O2 -t--> SO2
VD :td với kim loại 3Fe+ 2O2 -t---> Fe3O4
bài 2 :
- thu khí O2 ở bằng cách đun nóng nhuengx hợp chất giàu O2 và dễ bị phân hủy như KMnO4 . KClO3
pthh : 2KMnO4 --t--> K2MnO4 + MnO2 + O2
- thu khí oxi bằng cách đẩy kk và đẩy nước
bài 3
dạng tổng quát : M2Ox ( M là đơn chất )
- cách gọi tên : tên nguyên tố +oxit
Đúng 0
Bình luận (0)
Trong phòng thí nghiệm, 3 khí X, Y, Z được điều chế và thu như hình vẽ dưới đây: Viết phương trình hóa học điều chế các khí trên.
Đọc tiếp
Trong phòng thí nghiệm, 3 khí X, Y, Z được điều chế và thu như hình vẽ dưới đây:
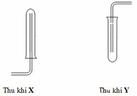

Viết phương trình hóa học điều chế các khí trên.
Chọn X: H2 ; Y : O2 ; Z: C2H2
Zn + 2HCl → ZnCl2 + H2
2KMnO4 →K2MnO4 + MnO2 + O2
CaC2 + 2H2O → Ca(OH)2 + C2H2
Đúng 0
Bình luận (0)
giúp m câu này nhaBài 1: Từ quạng pirit sắt, nước biển và ko khí. Viết phương trình điều chế FeCl2, Fecl3, FeSO4, Fe(OH)2, Na2SO3, NaHSO4Bài 2 : Phân đạm hai lá có CTHH là NH4NO3 và phân đamj urê có CTHH là (NH2)2CO. Viết các PTPƯ điều chế 2 phân đạm ns trên từ ko khí nước và đá vôiBài 3: Từ hỗn hợp chất rắnCu(OH).MgO.FeS. Viết các PTPUW điều chế CuBài 4: a, Hãy kể tên các loại sắt quan trọng trong tự nhiên.Trong các loaijn quăng đó có 2 quạng ko phải quặng oxit, nung nóng hai quăng này thu được...
Đọc tiếp
giúp m câu này nha
Bài 1: Từ quạng pirit sắt, nước biển và ko khí. Viết phương trình điều chế FeCl2, Fecl3, FeSO4, Fe(OH)2, Na2SO3, NaHSO4
Bài 2 : Phân đạm hai lá có CTHH là NH4NO3 và phân đamj urê có CTHH là (NH2)2CO. Viết các PTPƯ điều chế 2 phân đạm ns trên từ ko khí nước và đá vôi
Bài 3: Từ hỗn hợp chất rắn
Cu(OH).MgO.FeS. Viết các PTPUW điều chế Cu
Bài 4: a, Hãy kể tên các loại sắt quan trọng trong tự nhiên.Trong các loaijn quăng đó có 2 quạng ko phải quặng oxit, nung nóng hai quăng này thu được hai chất khí A và B. Viết các PT điều chế, nêu các cách nhận biết A và B ( phương pháp hóa học)
b, Từ một quặng bất kì trên hãy viết các PTPUW điều chế Fe(OH)2 và Fe(OH)3
điều chế FeCl2
2NaCl + 2H2O=> 2NaOH + H2 + Cl2
H2 + Cl2 => 2HCl
FeS2 + 2HCl=> FeCl2 + H2S+S
điều chế FeCl3
2FeCl2 + Cl2 => 2FeCl3
điều chế FeSO4
4FeS2 + 11O2=>2Fe2O3 + 8So2
2SO2 + O2 => 2SO3
SO3 + H2O=> H2SO4
FeS2 + H2SO4 => FeSO4 + H2S + S
điều chế Fe(OH)2
FeSO4+ 2NaOH=> Na2SO4 + Fe(OH)2
điều chế Na2SO3
2NaOH + SO2 => Na2SO3 + H2O
điều chế NaHSO4
2NaOH + H2SO4=> Na2SO4 + 2H2O
Đúng 0
Bình luận (0)
Câu 4:Người ta điều chế 7,437 lít khí hydrogen bằng cách cho Zinc tác dụng với hydrochloric acid.a. Viết phương trình hóa học của phản ứng trên.b. Tính khối lượng Zinc và acid đã phản ứng, tính khối lượng muối thu đượcc. Cho toàn bộ khí hydrogen sinh ra ở phản ứng trên đi qua bột iron (III) oxide, đun nóng. Tính khối lượng iron thu được.
Đọc tiếp
Câu 4:Người ta điều chế 7,437 lít khí hydrogen bằng cách cho Zinc tác dụng với hydrochloric acid.
a. Viết phương trình hóa học của phản ứng trên.
b. Tính khối lượng Zinc và acid đã phản ứng, tính khối lượng muối thu được
c. Cho toàn bộ khí hydrogen sinh ra ở phản ứng trên đi qua bột iron (III) oxide, đun nóng. Tính khối lượng iron thu được.
Zn+2HCl-to>ZnCl2+H2
0,3----0,6-----0,3----0,3
n H2=\(\dfrac{7,437}{24,79}\)=0,3 mol
=>m Zn=0,3.65=19,5g
=>m HCl=0,6.36,5=21,9g
=>m ZnCl2=0,3.136=40,8g
Fe2O3+3H2-to>2Fe+3H2O
0,1------0,3----------0,2 mol
=>m Fe=0,2.56=11,2g
Đúng 1
Bình luận (0)
a)\(n_{H_2}=\dfrac{7,437}{22,4}=0,332mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,332 0,664 0,332 0,332
b)\(m_{Zn}=0,332\cdot65=21,58g\)
\(m_{HCl}=0,664\cdot36,5=24,236g\)
\(m_{ZnCl_2}=0,332\cdot136=45,152g\)
c)\(3H_2+Fe_2O_3\rightarrow2Fe+3H_2O\)
0,332 0,221
\(m_{Fe}=0,221\cdot56=12,376g\)
Đúng 0
Bình luận (1)
Muốn điều chế được 3,36 lít khí oxi dktc thì khối lượng KMnO4 cần nhiệt phân là bao nhiêu Viết phương trình điều chế
Xem chi tiết
\(n_{O_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(2KMnO_4\underrightarrow{t^0}K_2MnO_4+MnO_2+O_2\)
\(0.3............................................0.15\)
\(m_{KMnO_4}=0.3\cdot158=47.4\left(g\right)\)
Đúng 2
Bình luận (0)
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\)
\(0,3\) \(0,15\) \(\left(mol\right)\)
\(m_{KMnO_4}=0,3.158=47,4\left(g\right)\)
Đúng 1
Bình luận (0)







