tính mol NaOH cần thêm vào 120g dung dịch NaOH 5% để thu được dung dịch NaOH 8%
KT
Những câu hỏi liên quan
Trong 400ml của một dung dich có chứa 120g NaOH
1) Hãy tính nồng độ mol của dung dịch này
2) Phải thêm bao nhiêu ml nước vào 200ml dung dịch này để được dung dịch NaOH 0,1gam/mol
1) nNaOH =120/40=3(mol)
CM(NaOH)=3/0,4=7,5 M
2) Nếu câu hỏi là NaOH 0,1 M
nNaOH=7,5.0,2=1,5(mol)
Số lít nước trong dung dịch: 1,5/0,1=15 (l)
=> Lượng nước cần thêm vào : 15 - 0,2=14,8 (l)=14800 ml
Đúng 0
Bình luận (0)
Có 100g dung dịch NaOH 5% (dung dịch A).
a) Cần phải trộn thêm vào dung dịch A bao nhiêu gam dung dịch NaOH 10% để được dung dịch NaOH 8%?
b) Cần hòa tan bao nhiêu gam NaOH vào dung dịch A để có dung dịch A để có dung dịch NaOH 8%?
c) Làm bay hơi nước dung dịch A, người ta cũng thu được dung dịch NaOH 8%. Tính khối lượng nước đã bay hơi.
Giúp em với ạ em cảm ơn
Có 200g dung dịch NaOH 5% (dung dịch A). Cần phải trộn thêm vào dung dịch A bao nhiêu gam dung dịch NaOH 10% để được dung dịch NaOH 8%?
Khối lượng NaOH có trong dung dịch ban đầu:
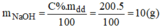
Gọi x(g) là khối lượng dung dịch NaOH 10% cần dùng:
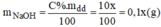
Đề thu được dung dịch 8% ta có:
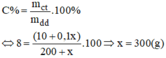
Vậy phải trộn thêm 300g dung dịch NaOH 10% ta sẽ có 500(g) dung dịch NaOH nồng độ 8%.
Đúng 0
Bình luận (0)
a) Hòa tan hoàn toàn 8g NaOH vào nước thu được 120g dung dịch. Tính nồng độ mol của dung dịch thu được? Biết dung dịch có khối lượng riêng là 1,2 g/ml.
b) Một dung dịch NaOH có khối lượng riêng là 1,2 g/ml. Khi đem 180 gam dung dịch này đi cô cạn thì thu được 21,6 gam NaOH. Tính nồng độ mol của dung dịch đã dùng
a.\(n_{NaOH}=\dfrac{8}{40}=0,2mol\)
\(V_{dd}=\dfrac{120}{1,2}=100ml=0,1l\)
\(C_{M_{NaOH}}=\dfrac{0,2}{0,1}=2M\)
b.\(n_{NaOH}=\dfrac{21,6}{40}=0,54mol\)
\(V_{dd}=\dfrac{180}{1,2}=150ml=0,15l\)
\(C_{M_{NaOH}}=\dfrac{0,54}{0,15}=3,6M\)
Đúng 2
Bình luận (0)
a: hòa tan hoàn toàn 0,3 mol NaOH vào nước thu được 0,5 lít dung dịch NaOH. tính nồng độ mol của dung dịch?
b: hòa tan hoàn tàn 24 gam NaOH vào nước thu được 400ml dung dịch NaOH. tính nồng độ mol của dung dịch?
\(a,C_{M\left(NaOH\right)}=\dfrac{0,3}{0,5}=0,6M\\ b,n_{NaOH}=\dfrac{24}{40}=0,6\left(mol\right)\\ C_{M\left(NaOH\right)}=\dfrac{0,6}{0,4}=1,5M\)
Đúng 1
Bình luận (0)
Câu 2: Trộn 200 ml dung dịch HCl 1M với 300 ml dung dịch HCl 1,5 M thu được dung dịch HCl có nồng độ mol/lit là bao nhiêu?
Câu 3: Cần thêm bao nhiêu ml H2O (D = 1 g/ml) vào 100 gam dung dịch NaOH 35% để thu được dung dịch NaOH 20%.
Câu 4: Cần pha bao nhiêu lít dung dịch HCl 2M với bao nhiêu lít dung dịch HCl 3M để thu được 4 lít dung dịch HCl 2,75M.
Câu 2 :
$n_{HCl} = 0,2.1 + 0,3.1,5 = 0,65(mol)$
$V_{dd} = 0,2 + 0,3 = 0,5(mol)$
$C_{M_{HCl}} = \dfrac{0,65}{0,5} =1,3M$
Câu 3 :
Gọi $m_{H_2O\ cần\ thêm} =a (gam)$
Sau khi thêm :
$m_{NaOH} = 100.35\% = 35(gam)$
$m_{dd} = 100 + a(gam)$
Suy ra: $\dfrac{35}{100 + a}.100\% = 20\%$
Suy ra: a = 75(gam)
Câu 4 :
Gọi $V_{dd\ HCl\ 2M} =a (lít) ; V_{dd\ HCl\ 3M} = b(lít)$
Ta có :
$a + b = 4$
$2a + 3b = 4.2,75$
Suy ra a = 1(lít) ; b = 3(lít)
Đúng 2
Bình luận (0)
Hoà tan 1 mol NaOH rắn vào dung dịch NaOH 0,5M để thu được dung dịch có nồng độ mol là 1,5M. Tính thể tích dung dịch NaOH. Biết rằng khi cho NaOH rắn vào nước cứ 20g làm tăng thể tích 5ml
Tính số mol P2O5 cần thêm vào 0,3 lít dung dịch hỗn hợp KOH 1M và NaOH 1M để sau phản ứng thu được dung dịch chứa hai anion HPO42- và H2PO4- với số mol bằng nhau:
A. 0,1
B. 0,2
C. 0,3
D. 0,4
Đáp án B
P2O5+ 3H2O → 2 H3PO4 (1)
Tổng số mol OH- có trong dung dịch là 0,3.1+0,3.1= 0,6 mol
Đặt số mol HPO42- là x mol, số mol H2PO4- là x mol
OH-+ H3PO4 →H2PO4-+ H2O (2)
2OH-+ H3PO4 → HPO42-+ 2H2O (3)
Theo PT (2), (3) có:
nOH-= nH2PO4-+ 2nHPO4(2-)= x+ 2x= 3x (mol)= 0,6
Suy ra x= 0,2 mol→ nH3PO4 PT (2), (3)= x+ x= 0,4 mol
→nP2O5= ½. nH3PO4= 0,2 mol
Đúng 0
Bình luận (0)
Tính lượng nước cần cho thêm vào 400g dung dịch NaOH 20% để được dung dịch NaOH 15%
\(m_{NaOH\left(20\%\right)}=\dfrac{400.20\%}{100\%}=80\left(g\right)\)
Gọi `x` (g) là khối lượng nước cần thêm:
Có: \(C\%_{NaOH}=\dfrac{80.100\%}{x+400}=15\%\)
=> `x=133,33` gam
Đúng 1
Bình luận (1)




