cân bằng phương trình theo phương pháp đại số:K + H2SO4 K2SO4 + H2S + H2O
NM
Những câu hỏi liên quan
Bài 1.Cân bằng phản ứng oxi hóa khử theo phương pháp thăng bằng electron : 1.H2S + SO2 = S + H2O 2.H2S + HClO = HCl + H2SO4 3.S + H2SO4 = SO2 + H2O 4.Fe3O4 + CO = Fe + CO2 5.P + H2SO4 = H3PO4 + SO2 + H2O 6. C + H2SO4 = CO2 + SO2 +H2O
Cân bằng phản ứng sau bằng phương pháp thăng bằng electron:
K
M
n
O
4
+
C
6
H
5
-
C
H
C
H
2
+
H
2
S
O
4
→
M
n
S
O
4
+
(...
Đọc tiếp
Cân bằng phản ứng sau bằng phương pháp thăng bằng electron:
K M n O 4 + C 6 H 5 - C H = C H 2 + H 2 S O 4 → M n S O 4 + ( Y ) + C O 2 + K 2 S O 4 + H 2 O
(Y) là kí hiệu của sản phẩm hữu cơ. Tổng số các hệ số cân bằng của phương trình là:
A. 15
B. 17
C. 25
D. 27
ABài 1.Cân bằng phản ứng oxi hóa khử theo phương pháp thăng bằng electron :
1.H2S + SO2 = S + H2O
2.H2S + HClO = HCl + H2SO4
3.S + H2SO4 = SO2 + H2O
4.Fe3O4 + CO = Fe + CO2
5.P + H2SO4 = H3PO4 + SO2 + H2O
6. C + H2SO4 = CO2 + SO2 +H2O
Cân bằng các phương trình phản ứng oxi hóa – khử sau đây bằng phương pháp thăng bằng electron và cho biết chất khử, chất oxi hóa ở mỗi phản ứng:
b) FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
e) Cl2 +KOH → KCl + KClO3 + H2O
b) 2FeSO4 + 2KMnO4 + 3H2SO4 → Fe2(SO4)3 + 2MnSO4 + K2SO4 + 3H2O
e) Cl2 +2KOH → KCl + KClO3 + H2O
Đúng 1
Bình luận (0)
Cân bằng phản ứng OXH khử bằng phương pháp thăng bằng e.A. HCl + KMnO4 — KCl + MnCl2 + Cl2 + H2OB. SO2 + KMnO4 + H2O — K2SO4 + MnSO4 + H2SO4C. FeSO4 + KMno4 + H2SO4 — K2SO4 + MnSO4 + Fe2(SO4)3 + H2OD. FeSO4 + K2Cr2O7 + H2SO4 — K2SO4 + Cr2(SO4)3 + Fe2(SO4)3 + H2O
Đọc tiếp
Cân bằng phản ứng OXH khử bằng phương pháp thăng bằng e.
A. HCl + KMnO4 —> KCl + MnCl2 + Cl2 + H2O
B. SO2 + KMnO4 + H2O —> K2SO4 + MnSO4 + H2SO4
C. FeSO4 + KMno4 + H2SO4 —> K2SO4 + MnSO4 + Fe2(SO4)3 + H2O
D. FeSO4 + K2Cr2O7 + H2SO4 —> K2SO4 + Cr2(SO4)3 + Fe2(SO4)3 + H2O
a)
- Quá trình oxi hóa: \(\overset{-1}{2Cl}\rightarrow\overset{0}{Cl_2}+2e\) (Nhân với 5)
- Quá trình khử: \(\overset{+7}{Mn}+5e\rightarrow\overset{+2}{Mn}\) (Nhân với 2)
PTHH: \(16HCl+2KMnO_4\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
b)
- Quá trình oxi hóa: \(\overset{+4}{S}\rightarrow\overset{+6}{S}+2e\) (Nhân với 5)
- Quá trình khử: \(\overset{+7}{Mn}+5e\rightarrow\overset{+2}{Mn}\) (Nhân với 2)
PTHH: \(5SO_2+2KMnO_4+2H_2O\rightarrow K_2SO_4+2MnSO_4+2H_2SO_4\)
c)
- Quá trình oxi hóa: \(\overset{+2}{2Fe}\rightarrow\overset{+3}{Fe_2}+2e\) (Nhân với 5)
- Quá trình khử: \(\overset{+7}{Mn}+5e\rightarrow\overset{+2}{Mn}\) (Nhân với 2)
PTHH: \(10FeSO_4+2KMnO_4+8H_2SO_4\rightarrow K_2SO_4+2MnSO_4+5Fe_2\left(SO_4\right)_3+8H_2O\)
d)
- Quá trình oxi hóa: \(\overset{+2}{2Fe}\rightarrow\overset{+3}{Fe_2}+2e\) (Nhân với 3)
- Quá trình khử: \(\overset{+6}{Cr_2}+6e\rightarrow\overset{+3}{Cr_2}\) (Nhân với 1)
PTHH: \(6FeSO_4+K_2Cr_2O_7+7H_2SO_4\rightarrow K_2SO_4+Cr_2\left(SO_4\right)_3+3Fe_2\left(SO_4\right)_3+7H_2O\)
Đúng 1
Bình luận (0)
cân bằng phương trình bằng phương pháp thăng bằng electron(1) FexOy + HNO3 → Fe(NO3)3 + NO2 + H2O(2)Fe + HNO3 → Fe(NO3)3 + NxOy + H2O(3) Fe3O4 + HNO3 → Fe(NO3)3 + NxOy + H2O(4) M + HNO3 → M(NO3)n + N2O + H2O(5) M + H2SO4 → M2(SO4)n + H2S + H2O(6)FexOy + Al → Al2O3 + Fe
Đọc tiếp
cân bằng phương trình bằng phương pháp thăng bằng electron
(1) FexOy + HNO3 → Fe(NO3)3 + NO2 + H2O
(2)Fe + HNO3 → Fe(NO3)3 + NxOy + H2O
(3) Fe3O4 + HNO3 → Fe(NO3)3 + NxOy + H2O
(4) M + HNO3 → M(NO3)n + N2O + H2O
(5) M + H2SO4 → M2(SO4)n + H2S + H2O
(6)FexOy + Al → Al2O3 + Fe
Cân bằng các phương trình sau theo phương pháp thăng bằng electron. Cho biết chất khử, chất oxi hóa.
a. SO2 + H2S → S + H2O
b. Al + HNO3 → Al(NO3)3 + NO + H2O
Dẫn khí SO2 vào dung dịch KMnO4 màu tím nhận thấy dung dịch bị mất màu, vì xảy ra phản ứng hóa học sau:
SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4
Hãy cân bằng phương trình hóa học trên bằng phương pháp thăng bằng electron.
Cân bằng phương trình phản ứng oxi hóa – khử:
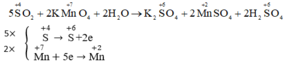
Đúng 0
Bình luận (0)
Cân bằng các phản ứng sau theo phương pháp electron:
1. SO2 + H2S rightarrow S + H2O
2. Al + Fe3O4 rightarrow Al2O3 + Fe
3. SO2 + Cl2 + H2O rightarrow H2SO4 + HCl
4. MnO2 + HCl rightarrow MnCl2 + Cl2 + H2O
5. Cu + HNO3 rightarrow Cu(NO3)2 + NO2 + H2O
6. Mg + H2SO4(n) rightarrow MgSO4 + S + H2O
7*. FeSO4 + KMnO4 + H2SO4 rightarrow Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
8*. H2S + KMnO4 + H2SO4 rightarrow MnSO4 + K2SO4 + Sdownarrow + H2O
Đọc tiếp
Cân bằng các phản ứng sau theo phương pháp electron:
1. SO2 + H2S \(\rightarrow\) S + H2O
2. Al + Fe3O4 \(\rightarrow\) Al2O3 + Fe
3. SO2 + Cl2 + H2O \(\rightarrow\) H2SO4 + HCl
4. MnO2 + HCl \(\rightarrow\) MnCl2 + Cl2 + H2O
5. Cu + HNO3 \(\rightarrow\) Cu(NO3)2 + NO2 + H2O
6. Mg + H2SO4(n) \(\rightarrow\) MgSO4 + S + H2O
7*. FeSO4 + KMnO4 + H2SO4 \(\rightarrow\) Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
8*. H2S + KMnO4 + H2SO4 \(\rightarrow\) MnSO4 + K2SO4 + S\(\downarrow\) + H2O








