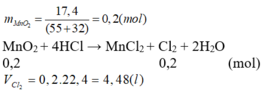cho 4.41 gam K2CrO7 vào dd HCl dư thể tích khí thoát ra là
VL
Những câu hỏi liên quan
3. Cho 6,5 gam Zn vào dd HCl lấy dư, sau phản ứng thu được chất khí. Tính thể tích khí thoát ra ở đktc, biết H% = 90%.
$n_{Zn} = \dfrac{6,5}{65} = 0,1(mol)$
$Zn + 2HCl \to ZnCl_2 + H_2$
$n_{H_2} = n_{Zn\ pư} = 0,1.90\% = 0,09(mol)$
$V_{H_2} = 0,09.22,4 = 2,016(lít)$
Đúng 1
Bình luận (0)
Cho 17,4 gam MnO2 tác dụng với dd HCl đặc, dư và đun nóng. Thể tích khí thoát ra (đktc) là: (Mn = 55)
A. 4,48 lít
B. 2,24 lít
C. 3,36 lít
D. 6,72 lít
cho 11,2g bột sắt vào 400g dd HCl 7,3%, khi phản ứng kết thúc:
chất nào còn dư sau phản ứng? dư bao nhiêu gam?
thể tích khí thoát ra ở đktc là bao nhiêu?
nồng độ % của các chất trong dd thu đc sau phản ứng là bao nhiêu?
nFe=0,2(mol)
mHCl=29,2(g) => nHCl=0,8(mol)
PTHH: Fe +2 HCl -> FeCl2 + H2
Ta có: 0,2/1 < 0,8/2
=> HCl dư, Fe hết, tính theo nFe
=> nFeCl2=nH2=nFe=0,2(mol) =>mFeCl2= 25,4(g)
=>V(H2,đktc)=0,2.22,4=4,48(l)
nHCl(p.ứ)=2.0,2=0,4(mol) => nHCl(dư)=0,4(mol)
=>mHCl(dư)=0,4.36,5=14,6(g)
mddsau= mddHCl + mFe- mH2=11,2+400-0,2.2=410,8(g)
=>C%ddHCl(dư)=(14,6/410,8).100=3,554%
C%ddFeCl2= (25,4/410,8).100=6,183%
Đúng 2
Bình luận (2)
Cho 5,4 gam nhôm vào dung dịch HCl dư , thể tích khí thoát ra (ở đktc) là
A. 4,48 lít
B. 6,72 lít
C. 13,44 lít
D. 8,96 lít
Hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3 với số mol mỗi chất là 0,1 mol. Hòa tan hết X vào dd Y gồm HCl và H2SO4 loãng dư thu được dd Z. Nhỏ từ từ dd Cu(NO3)2 1M vào dd Z cho tới khi khí NO ngừng thoát ra. Thể tích dung dịch Cu(NO3)2 cần dùng và thể tích khí thoát ra ở đktc là A. 500ml; 2,24lit B. 50ml; 1,12lit C. 50ml; 2,24lit D. 25 ml; 1,12lit
Đọc tiếp
Hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3 với số mol mỗi chất là 0,1 mol. Hòa tan hết X vào dd Y gồm HCl và H2SO4 loãng dư thu được dd Z. Nhỏ từ từ dd Cu(NO3)2 1M vào dd Z cho tới khi khí NO ngừng thoát ra. Thể tích dung dịch Cu(NO3)2 cần dùng và thể tích khí thoát ra ở đktc là
A. 500ml; 2,24lit
B. 50ml; 1,12lit
C. 50ml; 2,24lit
D. 25 ml; 1,12lit
nFe(2+) = nFe + nFeO + nFe3O4 = 0,3mol
3Fe(2+) + 4H+ + NO3- → 3Fe(3+) +NO +2H2O
nNO3- = 0,1 ->V Cu(NO3)2=50ml nNO = nNO3- = 0,1
→ V = 2,24=> Đáp án C
Đúng 0
Bình luận (0)
Cho một đinh sắt nặng 28 gam vào dd axit clohiđric HCl (dư) thu được sắt(II) clorua FeCl2 và khí hiđro.
a/ Viết PTHH.
b/ Tính khối lượng muối sắt(II) clorua thu được.
c/ Tính thể tích khí H2 thoát ra ở đktc .Một quả bóng có thể tích tối đa là 10 lít, hỏi quả bóng có chứa được hết lượng H2 thoát ra không?
a. PTHH : Fe + HCl -> FeCl2 + H2
b) \(n_{Fe}=\dfrac{28}{56}=0,5\left(mol\right)\)
\(n_{FeCl_2}=\dfrac{0,5}{2}=0,25\left(mol\right)\\ m_{FeCl_2}=0,25.127=31,75\left(g\right)\)
c) \(n_{H_2}=\dfrac{0,5}{1}=0,5\left(mol\right)\\ V_{H_2}=0,5.22,4=11,2\left(l\right)\)
Mà thể tích tối đa là 10 l -> quả bóng k chứa được hết lượng H2 thoát ra ngoài
Đúng 4
Bình luận (0)
Fe+2HCl->FeCl2+H2
0,5------------0,5-----0,5
=>n Fe=28\56=0,5 mol
=>m FeCl2=0,5.127=63,5g
=>VH2=0,5.22,4=11,2l
bóng 10l ko chứa hết đc nhé thừa 1,2l
Đúng 4
Bình luận (0)
Cho 69,6 gam MnO2 tác dụng với dd HCl đặc, dư. Dẫn khí thoát ra đi vào 500ml dd KOH 4M (ở nhiệt độ thường). Xác định nồng độ mol các chất trong dung dịch sau phản ứng (thể tích dd thay đổi không đáng kể).
\(n_{MnO_2}=\dfrac{69,6}{87}=0,8\left(mol\right)\)
nKOH = 0,5.4 = 2(mol)
PTHH: MnO2 + 4HCl --> MnCl2 + Cl2 + 2H2O
0,8------------------------>0,8
2KOH + Cl2 --> KCl + KClO + H2O
Xét tỉ lệ \(\dfrac{2}{2}>\dfrac{0,8}{1}\) => KOH dư, Cl2 hết
2KOH + Cl2 --> KCl + KClO + H2O
1,6<--0,8---->0,8---->0,8
=> \(\left\{{}\begin{matrix}n_{KOH\left(dư\right)}=2-1,6=0,4\left(mol\right)\\n_{KCl}=0,8\left(mol\right)\\n_{KClO}=0,8\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}C_{M\left(KOH\right)}=\dfrac{0,4}{0,5}=0,8M\\C_{M\left(KCl\right)}=\dfrac{0,8}{0,5}=1,6M\\C_{M\left(KClO\right)}=\dfrac{0,8}{0,5}=1,6M\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Cho hỗn hợp gồm 5,6 gam fe và 4,8 gam mg tác dụng hoàn toàn với dd hcl dư sinh ra V lít khí h2(đktc)
a) tính thể tích khí thoát ra ở đktc?
b)tính thể tích dd hcl2m cần dùng?
c)tính khối lượng muối thu được sau phản ứng
\(a)n_{Fe}=\dfrac{5,6}{56}=0,1mol\\ n_{Mg}=\dfrac{4,8}{24}=0,2mol\\ Fe+2HCl\rightarrow FeCl_2+H_2\)
0,1 0,2 0,1 0,1
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,2 0,4 0,2 0,2
\(V_{H_2}=\left(0,1+0,2\right).22,4=6,72l\\ b)V_{ddHCl}=\dfrac{0,2+0,4}{2}=0,3l\\ c)m_{muối}=0,1.127+95.0,2=31,7g\)
Đúng 2
Bình luận (0)
Cho một đinh sắt nặng 28 gam vào dd axit clohiđric HCl (dư) thu được sắt(II) clorua FeCl2 và khí hiđro.
a/ Viết PTHH.
b/ Tính khối lượng muối sắt(II) clorua thu được.
c/ Tính thể tích khí H2 thoát ra ở đktc. Một quả bóng Người ta đốt cháy 4,8 gam kim loại magie trong không khí (chứa oxi), sau phản ứng thu được chất rắn màu trắng là magie oxit MgO.
\(n_{Fe}=\dfrac{28}{56}=0,5mol\)
a, PTHH : \(Fe + 2HCl-> FECl_2+ H_2↑\)
0,5 0,5 0,5 (mol)
b/. Theo phương trình, ta có:
\(n_{FeCl_2}=n_{Fe}=0,5 mol\)
\(m_{FeCl_2}=0,5.127=63,5g\)
c, Thông cảm không biết làm
Đúng 2
Bình luận (6)
\(a,PTHH\left(1\right):Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
\(b,n_{Fe}=\dfrac{m}{M}=\dfrac{28}{56}=0,5\left(mol\right)\\ Theo.PTHH\left(1\right):n_{FeCl_2}=n_{Fe}=0,5\left(mol\right)\\ m_{FeCl_2}=n.M=0,5.91,5=45,75\left(g\right)\)
\(c,PTHH\left(2\right):2Mg+O_2\underrightarrow{t^o}2MgO\\ n_{Mg}=\dfrac{m}{M}=\dfrac{4,8}{24}=0,2\left(mol\right)\\ Theo.PTHH\left(2\right):n_{O_2}=2.n_{Mg}=0,2.2=0,4\left(mol\right)\\ V_{O_2\left(đktc\right)}=n.22,4=0,4.22,4=8,96\left(l\right)\)
(c lỗi đề à có oxi chứ ko có hidro nên mik thay bằng oxi nha)
Đúng 1
Bình luận (1)