Trong hợp chất oxi ,lưu huỳnh có chứa 2 gam lưu huỳnh và 3 gam oxi. Tìm công thức đơn giản nhất
H24
Những câu hỏi liên quan
Hãy tìm công thức hóa học đơn giản nhất của một loại oxit của lưu huỳnh, biết rằng trong oxit này có 2 g lưu huỳnh kết hợp với 3 g oxi.
\(\frac{n_S}{n_O}=\frac{\frac{2}{32}}{\frac{3}{16}}=\frac{1}{3}\Rightarrow SO_3\)
Đúng 0
Bình luận (1)
Giả sử CTHH là SxOy , ta có tỉ lệ:
\(\dfrac{x}{y}\)=\(\dfrac{2}{32}\):\(\dfrac{3}{16}\)=\(\dfrac{1}{3}\)⇒CTHH là SO3
Đúng 0
Bình luận (1)
Giả sử CTHH là SxOy , ta có tỉ lệ:
xyxy=232232:316316=1313⇒CTHH là SO3
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Hãy tìm công thức hóa học đơn giản nhất của một loại oxit của lưu huỳnh, biết rằng trong oxit này có 2g lưu huỳnh kết hợp với 3g oxi.
Số mol của nguyên tử lưu huỳnh là: 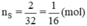
Số mol của nguyên tử oxi là: 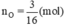
Ta có: 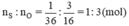
⇒ Trong một phân tử lưu huỳnh trioxit có 1 nguyên tử S và có 3 nguyên tử O.
Vậy công thức hóa học đơn giản nhất của oxit lưu huỳnh là SO3.
Đúng 0
Bình luận (0)
Tìm công thức hóa học đơn giản nhất của các hợp chất tạo bởi:
a)1 gam lưu huỳnh kết với 1 gam oxi
b) 2 gam lưu huỳnh kết với 3 gam oxi
c)70%khối lượng sắt;30%khối lượng oxi và có khối lượng mol là 160(g/mol).
d) 2,04%H;32,65%S; phần còn lại là oxi. Khối lượng mol của hợp chất là 98g/mol.
Giải nhanh giúp mình ạ
a)
Ta có: nS=\(\frac{1}{32}\) mol ;n O=\(\frac{1}{16}\)mol
\(\rightarrow\) Tỉ lệ nS:nO=1:2 \(\rightarrow\) SO2
b)
Ta có : nS=\(\frac{2}{32}\)=\(\frac{1}{16}\) mol; nO=\(\frac{3}{36}\)mol
\(\rightarrow\) Tỉ lệ nS:nO=1:3\(\rightarrow\)SO3
c) Chất này tạo bởi Fe và O \(\rightarrow\) Có dạng FexOy \(\rightarrow\) 56x+16y=160
Ta có %Fe=\(\frac{56x}{160}\)=70% \(\rightarrow\) x=2\(\rightarrow\) y=3 \(\rightarrow\)Fe2O3
d) Chất này tạo bởi H; S; O -> HxSyOz
\(\rightarrow\)x+32y+16z=98
\(\rightarrow\)%H=\(\frac{x}{98}\)=2,04% \(\rightarrow\) x=2
\(\rightarrow\)%S=\(\frac{32y}{98}\)=32,65%\(\rightarrow\) y=1\(\rightarrow\) z=4
\(\rightarrow\) H2SO4
Bài 11: Đốt cháy 6,4 gam lưu huỳnh trong bình chứa 16 gam khí oxi tạo thành Lưu huỳnh đioxit
a) Lưu huỳnh hay oxi chất nào còn dư và số mol chất còn dư là bao nhiêu?
b) Chất nào được tạo thành? Khối lượng là bao nhiêu?
\(n_S=\dfrac{6,4}{32}=0,2mol\)
\(n_{O_2}=\dfrac{16}{32}=0,5mol\)
\(S+O_2\underrightarrow{t^o}SO_2\)
0,2 0,5 0,2
Sau phản ứng oxi còn dư và dư \(0,5-0,2=0,3mol\)
Oxit axit được tạo thành là \(SO_2\) và có khối lượng:
\(m_{SO_2}=0,2\cdot64=12,8g\)
Đúng 2
Bình luận (0)
Tìm CTHH đơn giản nhất của các hợp chất tạo bởi 2 gam lưu huỳnh kết hợp với 3 gam oxi
Mn trả lời nhanh giúp mk nhé
Đang cần gấp
Bài kia mk lộn
\(m_S:m_O=\frac{2}{32}:\frac{3}{16}=0,0625:0,125=1:2\)
CTHH:SO2
Gọi x là số mol của S, y là số mol của O
\(\Rightarrow CTTQ:S_xO_y\)
\(\Rightarrow\frac{2}{32}:\frac{3}{16}=\frac{1}{3}\)
\(\Rightarrow x=1;y=3\Rightarrow CTHH:SO_3\)
Mk thấy bạn dưới sai rồi á
một hợp chất của lưu huỳnh và oxi có thành phần khối lượng là 50% lưu huỳnh vào 50% oxi. Vậy Công thức hóa học là
Gọi số nguyên tử lưu huỳnh trong phân tử hợp chất là x (nguyên tử), số nguyên tử oxi là y (nguyên tử). ĐK: \(x;y\in \mathbb N^*\)
Ta có:
\(\left\{{}\begin{matrix}\dfrac{32x}{32x+16y}\cdot100=50\\\dfrac{16y}{32x+16y}\cdot100=50\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=1\\y=2\end{matrix}\right.\) (TMĐK)
Vậy công thức hoá học của hợp chất đã cho là SO2.
Đúng 0
Bình luận (0)
Bài 1: Đốt cháy 3,2g lưu huỳnh trong bình chứa 1,121khí oxi (đktc).
a/ Lưu huỳnh hay oxi, chất nào còn dư và dư bao nhiêu gam hoặc lít?
b/ Tính khối lượng khí sunfurơ tạo thành?
nS=mS/MS=3,2/32=0,1(mol)
nO2=VO2/22,4=32/22,4=1,42(mol)
PTHH: S + O2 --> SO2 (1)
BĐ: 0,1 1,42
PỨ: 0,1-->0,1-->0,1
SPỨ: 0--->0,32-->0,1
a) Từ PT(1)=>O2 dư
VO2(dư)=nO2(dư) .22,4=0,32 .22,4=7,168(l)
b) Từ PT(1)=>nSO2=0,1(mol)
=>mSO2=n.M=0,1 .64=6,4(g)
hãy tìm cthh đơn giản nhất của một loại lưu huỳnh oxit, biết rằng trong oxit này có 2 gam s kết hợp với 3 gam oxi
mai mình nộp rồi
Gọi CTHH của oxit là SxOy
Ta có: x: y = \(\dfrac{2}{32}:\dfrac{3}{16}=1:3\)
=> x = 1; y = 3
Vậy CTHH: SO3
Đúng 0
Bình luận (0)
Gọi CTHH của oxit là SxOy
Ta có: x: y = 232:316=1:3232:316=1:3
=> x = 1; y = 3
Vậy CTHH: SO3
Đúng 0
Bình luận (0)
oxi hóa hoàn toàn m gam hỗn hợp lưu huỳnh và phốt pho trong bình chứa khí oxi dư thu được một chất khí có mùi hắc khó thở và 28,4g một chất bột màu trắng bám trên thành bình






 like nha
like nha