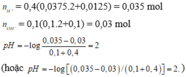Trộn 300 ml dd HCl 0.09M với V ml dd H2SO4 0.06M thu được dd có pH = 1.0969 . Tính giá trị V
H24
Những câu hỏi liên quan
Trộn 300 ml dd hh gồm H2SO4 0,1M và HCl 0, 15M với V ml dd hh gồm NaOH 0,3M và Ba(OH)2 0,1M, thu được dd X có pH = 12. Giá trị của V là:
\(n_{H^+}=0.3\cdot0.1\cdot2+0.3\cdot0.15=0.105\left(mol\right)\)
\(n_{OH^-}=0.001V\cdot0.3+0.001V\cdot2\cdot0.1=0.0032V\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(0.105.......0.105\)
\(n_{OH^-\left(dư\right)}=0.0032V-0.105\left(mol\right)\)
\(\left[OH^-\right]=\dfrac{0.0032V-0.105}{0.3+0.001V}\left(M\right)\)
\(pH=14+log\left[OH^-\right]=12\)
\(\Leftrightarrow log\left[OH^-\right]=-2\)
\(\Leftrightarrow log\left[\dfrac{0.0032V-0.105}{0.3+0.001V}\right]=-2\)
\(\Leftrightarrow V=33.85\left(ml\right)\)
Đúng 0
Bình luận (0)
nH+=0,3.0,1.2+0,3.0,15=0,105 mol
nOH- ban đầu =0,3V + 0,1.2V=0,5V mol
Sau phản ứng thu được dung dịch có pH=12
⇒OH- dư ⇒ pOH=2
⇒ [OH- ] dư = 0,01 M
nOH- dư = 0,01(0,3+V)=0,003+0,01V (mol)
nOH- phản ứng=nOH- ban đầu - nOH- dư
= 0,5V - 0,003 - 0,01V
= 0,49V - 0,003 (mol )
H+ + OH- → H2O
0,105 → 0,105
nOH- phản ứng = nH+
⇒0,49V - 0,003 =0,105
⇒ V≃0,22 lít=200ml
Đúng 0
Bình luận (0)
Trộn 300 ml dd HCl 0,09M với V ml dd H2SO4 0,06M thu được dung dịch có pH=1,0969
\(n_{H^+}=0,3.0,09+0,06.2.0,001V=0,02712\left(mol\right)\\ \Rightarrow pH=-log\left[H^+\right]=1,0969\\ \Leftrightarrow\left[H^+\right]\approx0,08\left(M\right)\\ \Rightarrow V_{ddsau}\approx\dfrac{0,02712}{0,08}\approx0,339\left(l\right)\approx339\left(ml\right)\\ \Rightarrow V=V_{ddH_2SO_4}\approx339-300\approx39\left(ml\right)\)
Đúng 1
Bình luận (0)
Trộn lẫn 3 dd H2SO4 0,1M, HNO3 0,2M và HCl 0,3M với những thể tích bằng nhau thu được dd A. Lấy 300 ml dd A cho phản ứng với V lít dd B gồm NaOH 0,2M và KOH 0,29M thu được dd C có pH 2. Giá trị V là: A. 0,424 lít B. 0,214 lít C. 0,414 lít D. 0,134 lít
Đọc tiếp
Trộn lẫn 3 dd H2SO4 0,1M, HNO3 0,2M và HCl 0,3M với những thể tích bằng nhau thu được dd A. Lấy 300 ml dd A cho phản ứng với V lít dd B gồm NaOH 0,2M và KOH 0,29M thu được dd C có pH = 2. Giá trị V là:
A. 0,424 lít
B. 0,214 lít
C. 0,414 lít
D. 0,134 lít
Để có được 300ml dung dịch A thi phải cần mỗi dung dịch axit là 100ml
=> tổng n H+= ( 0,1.2 + 0,2 + 0,3 ). 0,1 = 0,07 mol
Ở dung dịch B có tổng n OH− = 0,49.V mol
rõ ràng dung dịch thu được pH = 2 => dư H^+ = 0,01. ( 0,3 + v ) mol (1)
phản ứng : H+ +OH− → H2O
theo phản ứng thì nH+ dư = 0,07 - 0,49.V (2) từ 1 và 2 => 0,07 - 0,49.V = 0,01. ( 0,3 + v )
=> V = 0,134 lit
=> Đáp án D
Đúng 0
Bình luận (0)
Ví dụ 3: Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03M được 2V ml dung dịch Y. Dung dịch Y có pH làVí dụ 4: Trộn 20 ml dd HCl 0,05M với 20 ml dd H2SO4 0,075M thu được 40ml dd có pH bằngVí dụ 5: Trộn 20 ml dd KOH 0,35M với 80 ml dung dịch HCl 0,1 M được 100ml dd có pH làVí dụ 6: Cho 40ml dd HCl 0,75M vào 160ml dd chứa đồng thời Ba(OH)2 0,08M và KOH 0,04M thu được 200ml dd có pH là Ví dụ 7: Trộn 100ml dd hỗn hợp gồm Ba(OH)2 0,1M và NaOH 0,1M với 400ml dd hỗn hợp gồm H...
Đọc tiếp
Ví dụ 3: Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03M được 2V ml dung dịch Y. Dung dịch Y có pH là
Ví dụ 4: Trộn 20 ml dd HCl 0,05M với 20 ml dd H2SO4 0,075M thu được 40ml dd có pH bằng
Ví dụ 5: Trộn 20 ml dd KOH 0,35M với 80 ml dung dịch HCl 0,1 M được 100ml dd có pH là
Ví dụ 6: Cho 40ml dd HCl 0,75M vào 160ml dd chứa đồng thời Ba(OH)2 0,08M và KOH 0,04M thu được 200ml dd có pH là
Ví dụ 7: Trộn 100ml dd hỗn hợp gồm Ba(OH)2 0,1M và NaOH 0,1M với 400ml dd hỗn hợp gồm H2SO4 0,0375M và HCl 0,0125M thu được dd có pH là
Ví dụ 8: Trộn lẫn 2 dd có thể tích bằng nhau của dd HCl 0,2M và dd Ba(OH)2 0,2M. pH của dd thu được là
Ví dụ 9: Trộn hai thể tích dd HCl 0,1M với một thể tích dd gồm NaOH 0,2M và Ba(OH)2 0,15M thu được dd Z có pH là
Ví dụ 10: Trộn 300 ml dd HCl 0,05 M với 200 ml dd Ba(OH)2 x mol/l thu được 500 ml dd có pH=2. Giá trị của x là
Ví dụ 11: Trộn 300 ml dd HCl 0,05 M với 200 ml dd Ba(OH)2 a mol/l thu được 500 ml dd có pH=12. Giá trị của a là
Ví dụ 12: Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M, thu được dung dịch X. Dung dịch X có pH bằng
Ví dụ 13: Trung hòa 300 ml dung dịch hỗn hợp HCl và HNO3 có pH=2 cần V ml dung dịch NaOH 0,02M. Giá trị của V là
Ví dụ 14: Pha loãng dung dịch HCl có pH = 3 bao nhiêu lần để được dung dịch mới có pH = 4?
Ví dụ 5 :
n KOH = 0,02.0,35 = 0,007(mol)
n HCl = 0,08.0,1 = 0,008(mol)
$KOH + HCl \to KCl + H_2O$
n HCl pư = n KOH = 0,007(mol)
=> n HCl dư = 0,008 - 0,007 = 0,001(mol)
V dd = 0,02 + 0,08 = 0,1(mol)
=> [H+ ] = CM HCl dư = 0,001/0,1 = 0,01M
=> pH = -log(0,01) = 2
Đúng 3
Bình luận (0)
Ví dụ 3 :
n NaOH = 0,01.0,001V(mol)
n HCl = 0,03.0,001V(mol)
$HCl + NaOH \to NaCl + H_2O$
n HCl dư = 0,03.0,001V - 0,01.0,001V = 0,02.0,001V(mol)
Suy ra :
[H+ ] = CM HCl dư = 0,02.0,001V/0,002V = 0,01(M)
=> pH = -log(0,01) = 2
Đúng 4
Bình luận (0)
Ví dụ 4 :
n HCl = 0,02.0,05 = 0,001(mol)
n H2SO4 = 0,02.0,075 = 0,0015(mol)
=> n H+ = 0,001 + 0,0015.2 = 0,004(mol)
V dd = 0,02 + 0,02 = 0,04(ml)
=> [H+ ] = 0,004/0,04 = 0,1M
=> pH = - log(0,1) = 1
Đúng 4
Bình luận (0)
Trộn 100 ml dd (gồm Ba(OH)2 0,1M và NaOH 0,1M) với 400 ml dd (gồm H2SO4 0,0375M và HCl 0,0125M), thu được dd X. Giá trị pH của dd X là
A.7.
B. 2.
C. 1.
D. 6.
13. Trộn 300ml dd HCl 0,1M vào 200ml dd H2SO4 0,05M thì thu đc dd X có pH là a. Giá trị của a là?
16. Trộn V1(ml) dd HCl 0,001M vào V2(ml) dd H2SO4 0,05M thì thu đc 100ml dd có pH bằng 1,153. Giá trị V1 và V2 lần lượt là?
C1
nH2SO4 = 0,2.0,05 = 0,01 mol
nHCl = 0,3.0,1 = 0,03 mol
=> nH+ = 2nH2SO4 + nHCl = 2.0,01 + 0,03 = 0,05 mol
=> [H] = n/V = 0,05/(0,2 + 0,3) = 0,1
=> pH = -log[H+] = -log(0,1) = 1
Đúng 0
Bình luận (0)
Mọi người giải giúp mk vs ạCâu 15: Trộn 200 ml dd gồm HCl 0,1M và H2SO4 0,05 M với 300 ml dd Ba(OH)2 a mol/l thu được m gam kết tủa và 500 ml dd có pH13. Giá trị của a và m tương ứng làA. 0,15 và 2,33. B. 0,3 và 10,485. C. 0,15 và 10,485. D. 0,3 và 2,33.Câu 16: Dung dịch X chứa hỗn hợp NaOH 0,25M và Ba(OH)2 0,15M, dung dịch Y chứa hỗn hợp H2SO4 0,5M và HNO3 0,2M. Trộn V lít dung dịch X với V’ lít dung dịch Y, thu được dung dịch Z có pH 3. Tỉ lệ V/V’ làA. 2,17. B. 1,25. C. 0,46. D. 0,0...
Đọc tiếp
Mọi người giải giúp mk vs ạ
Câu 15: Trộn 200 ml dd gồm HCl 0,1M và H2SO4 0,05 M với 300 ml dd Ba(OH)2 a mol/l thu được m gam kết tủa và 500 ml dd có pH=13. Giá trị của a và m tương ứng là
A. 0,15 và 2,33. B. 0,3 và 10,485. C. 0,15 và 10,485. D. 0,3 và 2,33.
Câu 16: Dung dịch X chứa hỗn hợp NaOH 0,25M và Ba(OH)2 0,15M, dung dịch Y chứa hỗn hợp H2SO4 0,5M và HNO3 0,2M. Trộn V lít dung dịch X với V’ lít dung dịch Y, thu được dung dịch Z có pH =3. Tỉ lệ V/V’ là
A. 2,17. B. 1,25. C. 0,46. D. 0,08.
Câu 17: Trộn hai dung dịch H2SO4 0,1M và HCl 0,3M với những thể tích bằng nhau, thu được dung dịch X. Lấy 450 ml dung dịch X cho tác dụng với V lít dung dịch Y gồm NaOH 0,15M và KOH 0,05M, thu được dung dịch Z có pH = 1. Giá trị của V là
A. 0,225. B. 0,155. C. 0,450. D. 0,650.
Câu 18: Trộn lẫn 3 dung dịch H2SO4 0,1M, HNO3 0,2M và HCl 0,3M với những thể tích bằng nhau, thu được dung dịch X. Lấy 300 ml dung dịch X cho phản ứng với V lít dung dịch Y gồm NaOH 0,2M và KOH 0,29M, thu được dung dịch Z có pH = 2. Giá trị V là
A. 0,134 lít. B. 0,214 lít. C. 0,414 lít. D. 0,424 lít.
Câu 19: Dung dịch X thu được khi trộn một thể tích dung dịch H2SO4 0,1M với một thể tích dung dịch HCl 0,2M. Dung dịch Y chứa NaOH 0,2M và Ba(OH)2 0,1M. Đổ 100 ml dung dịch X vào 100 ml dung dịch Y, khuấy đều để phản ứng xảy ra hoàn toàn, thu được 200 ml dung dịch X có pH = a và m gam kết tủa Y. Giá trị của a và m lần lượt là
A. 13 và 1,165. B. 2 và 2,330. C. 13 và 2,330. D. 7 và 1,165.
Câu 20: Trộn các dung dịch HCl 0,75M; HNO3 0,15M; H2SO4 0,3M với các thể tích bằng nhau thì được dung dịch X. Trộn 300 ml dung dịch X với 200 ml dung dịch Ba(OH)2 0,25M, thu được m gam kết tủa và dung dịch Y có pH = x. Giá trị của x và m lần lượt là:
A. 1 và 2,23 gam. B. 1 và 6,99 gam. C. 2 và 2,23 gam. D. 2 và 1,165 gam.
Câu 21: Trộn 200 ml dung dịch gồm HCl 0,1M và H2SO4 0,05M với 300 ml dung dịch Ba(OH)2 nồng độ xM, thu được m gam kết tủa và 500 ml dung dịch có pH = 13. Giá trị của x và m là
A. x = 0,015; m = 2,33. B. x = 0,150; m = 2,33. C. x = 0,200; m = 3,23. D. x = 0,020; m = 3,23.
Câu 22: Cho dung dịch X chứa hỗn hợp H2SO4 0,1M và HNO3 0,3M, dung dịch Y chứa hỗn hợp Ba(OH)2 0,2M và KOH 0,1M. Lấy a lít dung dịch X cho vào b lít dung dịch Y, thu được 1 lít dung dịch Z có pH = 13. Giá trị a, b lần lượt là
A. 0,5 lít và 0,5 lít. B. 0,6 lít và 0,4 lít.
C. 0,4 lít và 0,6 lít. D. 0,7 lít và 0,3 lít.
Câu 23: Dung dịch X gồm HCl 0,2M; HNO3 0,3M; H2SO4 0,1M; HClO4 0,3M, dung dịch Y gồm KOH 0,3M; NaOH 0,4M; Ba(OH)2 0,15M. Cần trộn X và Y theo tỉ lệ thể tích là bao nhiêu để được dung dịch có pH = 13?
A. 11: 9. B. 9 : 11. C. 101 : 99. D. 99 : 101.
Câu 15 :
$n_{HCl} = 0,2.0,1 = 0,02(mol)$
$n_{H_2SO_4} = 0,2.0,05 = 0,01(mol)$
$\Rightarrow n_{H^+} = 0,02 + 0,01.2 = 0,04(mol)$
$n_{OH^-\ dư} = 0,5.(10-14 : 10-13) = 0,05(mol)$
$H^+ + OH^- \to H_2O$
$n_{OH^-} = 0,04 + 0,05 = 0,09(mol)$
$n_{Ba(OH)_2} = \dfrac{1}{2}n_{OH^-} = 0,045(mol)$
$a = 0,045 : 0,3 = 0,15(M)$
$Ba^{2+} + SO_4^{2-} \to BaSO_4$
$n_{Ba^{2+}} = 0,045 > n_{SO_4^{2-}} = 0,01$ nên $Ba^{2+}$ dư
n BaSO4 = n SO4 = 0,01(mol)
=> m = 0,01.233 = 2,33(gam)
Đáp án A
Đúng 3
Bình luận (0)
dd A chứa HCl, dd B chứa NaOH
- trộn 200 ml dd B với 300 ml dd A thu được dd C có tính axit. Thêm 0,14 lít dd KOH 1,4M vào 0,2 lít đ C thì thu được dd có tính trung hòa.
- trộn 200 ml dd A với 300 ml dd B thu được dd D có tính bazơ. Thêm 40 ml dd H2SO4 0,2M vào 200 ml dd D thì thu được dd có tính trung hòa.
Xác định CM của dd A và dd B
Trộn 250 ml dd hỗn hợp HCl 0,08 mol/l và H2SO4 0,01 mol/l với 250 ml dd Ba(OH)2 có nồng độ x mol/l thu được m gam kết tủa và 500 ml dd có pH 12. Hãy tính m và x. A. 0,06M và 5,825 gam B. 0,01 M và 4,66 gam C. 0,06M và 0,5825 gam D. 0,0125M và 3,495 gam
Đọc tiếp
Trộn 250 ml dd hỗn hợp HCl 0,08 mol/l và H2SO4 0,01 mol/l với 250 ml dd Ba(OH)2 có nồng độ x mol/l thu được m gam kết tủa và 500 ml dd có pH = 12. Hãy tính m và x.
A. 0,06M và 5,825 gam
B. 0,01 M và 4,66 gam
C. 0,06M và 0,5825 gam
D. 0,0125M và 3,495 gam
Đáp án C
nBa(OH)2 = 0,25 x mol; nOH-= 0,5x mol
nH+ = 0,025 mol, nSO4(2-) = 0,0025 mol
H++ OH- → H2O
0,025 0,025 mol
Dung dịch sau phản ứng có pH = 12 nên OH- dư
nOH- dư = 0,5x- 0,025
[OH-] dư = nOH- dư/ Vdd = (0,5x- 0,025)/0,5 =10-2 suy ra a = 0,06 M
Ba2++ SO42- → BaSO4
0,015 0,0025 0,0025 mol
mBaSO4 = 0,5825 gam
Đúng 0
Bình luận (0)