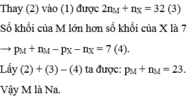nguyên tử ion X2-có tổng số hạt cơ bản là 26 trong đó số p=n
NT
Những câu hỏi liên quan
Hai nguyên tử X và Y có tổng số hạt cơ bản proton, nơtron, electron là 142. Trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 142. Trong đó tổng số hạt mang điệm nhiều hơn số hạt không mang điện là 42. Tỉ lệ số proton của ion X2+ và Y3+ ion là 10/13. Ở trạng thái cơ bản số electron độc thân của nguyên tử X và ion Y3+ lần lượt là A. 2 và 3 B. 0 và 4 C. 0 và 5 D. 2 và 4
Đọc tiếp
Hai nguyên tử X và Y có tổng số hạt cơ bản proton, nơtron, electron là 142. Trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 142. Trong đó tổng số hạt mang điệm nhiều hơn số hạt không mang điện là 42. Tỉ lệ số proton của ion X2+ và Y3+ ion là 10/13. Ở trạng thái cơ bản số electron độc thân của nguyên tử X và ion Y3+ lần lượt là
A. 2 và 3
B. 0 và 4
C. 0 và 5
D. 2 và 4
Đáp án A
Theo giả thiết ta có: 2 Z X + 2 Z Y + N X + N Y = 142 ( 2 Z X + 2 Z Y ) - ( N X + N Y ) = 42 ⇔ Z X + Z Y = 46 ( 1 ) N X + N Y = 50 ( 2 )
Mặt khác ta lại có: Tỉ lệ số proton của ion X 2 + và ion Y 3 + là 10 13 ⇒ Z X Z Y = 10 13 ( 3 )
Từ (1) và (3) ta có Z X = 20 ( C a ) v à Z Y = 26 ( F e )
X có cấu hình electron là: 1s22s22p63s23p64s2.
⇒ X có 0 electron độc thân
Fe có cấu hình là 1s22s22p63s23p63d64s2
⇒ F e 3 + có cấu hình là 1s22s22p63s23p63d5
⇒ F e 3 + có 5 electron độc thân
Chú ý: Đây là một bài khá dễ nhưng sẽ có nhiều bạn mắc phải sai lầm đáng tiếc là khi đề cho giả thiết: Tỉ lệ số proton của ion X 2 + và ion Y 3 + là 10 13
Theo quán tính sẽ có rất nhiều bạn sẽ thành lập phương trình sau: Z X - 2 Z Y - 3 = 10 13 dẫn đến không tìm ra kết quả đúng. Ở đây giả thiết cho là proton (hạt mang điện trong hạt nhân) chứ không phải electron (hạt mang điện lớp vỏ). Vì vậy trong quá trình làm bài các bạn nên đọc thật kỹ đề và không nên làm theo quán tính đọc hiểu đề và tư duy ngay cách làm.
Đúng 0
Bình luận (0)
Hai nguyên tử X và Y có tổng số hạt cơ bản proton, nơtron, electron là 142. Trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 142. Trong đó tổng số hạt mang điệm nhiều hơn số hạt không mang điện là 42. Tỉ lệ số proton của ion X2+ và Y3+ ion là 10/13. Ở trạng thái cơ bản số electron độc thân của nguyên tử X và ion Y3+ lần lượt là A. 2 và 3 B. 0 và 4 C. 0 và 5 D. 2 và 4
Đọc tiếp
Hai nguyên tử X và Y có tổng số hạt cơ bản proton, nơtron, electron là 142. Trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 142. Trong đó tổng số hạt mang điệm nhiều hơn số hạt không mang điện là 42. Tỉ lệ số proton của ion X2+ và Y3+ ion là 10/13. Ở trạng thái cơ bản số electron độc thân của nguyên tử X và ion Y3+ lần lượt là
A. 2 và 3
B. 0 và 4
C. 0 và 5
D. 2 và 4

X có cấu hình electron là: 1s22s22p63s23p64s2.
⇒ X có 0 electron độc thân
Fe có cấu hình là 1s22s22p63s23p63d64s2
⇒ F e 3 + có cấu hình là 1s22s22p63s23p63d5
⇒ F e 3 + có 5 electron độc thân
Chú ý: Đây là một bài khá dễ nhưng sẽ có nhiều bạn mắc phải sai lầm đáng tiếc là khi đề cho giả thiết: Tỉ lệ số proton của ion X 2 + và ion Y 3 + là 10 13
Theo quán tính sẽ có rất nhiều bạn sẽ thành lập phương trình sau: Z X - 2 Z y - 3 = 10 13 dẫn đến không tìm ra kết quả đúng. Ở đây giả thiết cho là proton (hạt mang điện trong hạt nhân) chứ không phải electron (hạt mang điện lớp vỏ). Vì vậy trong quá trình làm bài các bạn nên đọc thật kỹ đề và không nên làm theo quán tính đọc hiểu đề và tư duy ngay cách làm.
Đáp án C
Đúng 0
Bình luận (0)
Nguyên tử của nguyên tố X có tổng số hạt cơ bản là 82, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22. Cấu hình electron của ion
X
2
+
là A.
[
Ar
]
3
d
4
4
s
2
B.
[
Ar
]
3
d
6...
Đọc tiếp
Nguyên tử của nguyên tố X có tổng số hạt cơ bản là 82, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22. Cấu hình electron của ion X 2 + là
A. [ Ar ] 3 d 4 4 s 2
B. [ Ar ] 3 d 6
C. [ Ar ] 3 d 5 4 s 1
D. [ Ar ] 3 d 6 4 s 1
Câu 1. Cho các thông tin sau:Ion X2- có cấu hình electron: 1s22s22p63s23p6.Nguyên tố Y có tổng số hạt cơ bản trong nguyên tử là 40. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12.Ion Z2+ có tổng số hạt mang điện tích dương trong hạt nhân bằng 29.Vị trí của X, Y, Z trong bảng tuần hoàn lần lượt là: A. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 29, chu kì 4, nhóm IB).B. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IA); (Z: ô 29...
Đọc tiếp
Câu 1. Cho các thông tin sau:
Ion X2- có cấu hình electron: 1s22s22p63s23p6.
Nguyên tố Y có tổng số hạt cơ bản trong nguyên tử là 40. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12.
Ion Z2+ có tổng số hạt mang điện tích dương trong hạt nhân bằng 29.
Vị trí của X, Y, Z trong bảng tuần hoàn lần lượt là:
A. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 29, chu kì 4, nhóm IB).
B. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IA); (Z: ô 29, chu kì 4, nhóm IIB).
C. (X: ô 20, chu kỳ 4, nhóm IIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 29, chu kì 4, nhóm IB).
D. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 31, chu kì 4, nhóm IIIA).
X có cấu hình Electron: \(1s^22s^22p^63s^23p^4\) \(\rightarrow\) X thuộc ô 16, chu kì 3, nhóm VIA
Y có: \(\left\{{}\begin{matrix}p+e+n=40\\p+e-n=12\end{matrix}\right.\) \(\Rightarrow\) \(\left\{{}\begin{matrix}p=e=13\\n=14\end{matrix}\right.\) có cấu hình Electron \(1s^22s^22p^63s^23p^1\) \(\Rightarrow\) Y thuộc ô số 13, chu kì 3, nhóm IIIA
\(Z^{2+}\) có: p = 29 \(\Rightarrow\) p của Z cũng bằng 29 (= e) nên p có cấu hình electron: \(1s^22s^22p^63s^23p^64s^13d^{10}\)
Suy ra Z thuộc ô 29, chu kì 4, nhóm IB.
Chọn câu A.
Đúng 1
Bình luận (0)
Câu 1. Cho các thông tin sau:Ion X2- có cấu hình electron: 1s22s22p63s23p6.Nguyên tố Y có tổng số hạt cơ bản trong nguyên tử là 40. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12.Ion Z2+ có tổng số hạt mang điện tích dương trong hạt nhân bằng 29.Vị trí của X, Y, Z trong bảng tuần hoàn lần lượt là: A. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 29, chu kì 4, nhóm IB).B. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IA); (Z: ô 29...
Đọc tiếp
Câu 1. Cho các thông tin sau:
Ion X2- có cấu hình electron: 1s22s22p63s23p6.
Nguyên tố Y có tổng số hạt cơ bản trong nguyên tử là 40. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12.
Ion Z2+ có tổng số hạt mang điện tích dương trong hạt nhân bằng 29.
Vị trí của X, Y, Z trong bảng tuần hoàn lần lượt là:
A. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 29, chu kì 4, nhóm IB).
B. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IA); (Z: ô 29, chu kì 4, nhóm IIB).
C. (X: ô 20, chu kỳ 4, nhóm IIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 29, chu kì 4, nhóm IB).
D. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 31, chu kì 4, nhóm IIIA
Cho các thông tin sau: Ion
X
2
-
có cấu trúc electron:
1
s
2
2
s
2
2
p
6
3
s
2
3
p
6
Nguyên tố Y có tổng số hạt cơ bản trong nguyên tử là 40. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là...
Đọc tiếp
Cho các thông tin sau:
Ion X 2 - có cấu trúc electron: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6
Nguyên tố Y có tổng số hạt cơ bản trong nguyên tử là 40. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12.
Ion Z 2 + có tổng số hạt mang điện tích dương trong hạt nhân bằng 29.
Vị trí của X, Y, Z trong bảng tuần hoàn lần lượt là:
A. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 29, chu kì 4, nhóm IB).
B. (X: ô 16, chu kỳ 3, nhóm VIA); (Y: ô 13, chu kì 3, nhóm IA); (Z: ô 29, chu kì 4, nhóm IIB).
C. (X: ô 20, chu kỳ 4, nhóm IIA); (Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 29, chu kì 4, nhóm IB).
D. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 31, chu kì 4, nhóm IIIA).
Hợp chất A được tạo thành từ ion
M
+
và ion
X
2
-
(được tạo ra từ các nguyên tố M và X tương ứng). Trong phân tử A có tổng số các hạt cơ bản là 92, trong đó số hạt mang điện bằng 65,22% tổng số hạt. Số khối của M lớn hơn của X là 7. Nguyên tố M là: A. Li B. Na C. K D. H
Đọc tiếp
Hợp chất A được tạo thành từ ion M + và ion X 2 - (được tạo ra từ các nguyên tố M và X tương ứng). Trong phân tử A có tổng số các hạt cơ bản là 92, trong đó số hạt mang điện bằng 65,22% tổng số hạt. Số khối của M lớn hơn của X là 7. Nguyên tố M là:
A. Li
B. Na
C. K
D. H
Cho các thông tin sau: Ion X2- có cấu trúc electron: 1s22s22p63s23p6. Nguyến tố Y có tổng số hạt cơ bản trong nguyên tử là 40. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12. Ion Z2+ có tổng số hạt mang điện tích dương trong hạt nhân bằng 29. Vị trí của X, Y, Z trong bảng tuần hoàn lần lượt là: A. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 29, chu kì 4, nhóm IB). B. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IA); (Z: ô 29, chu kì 4, nhó...
Đọc tiếp
Cho các thông tin sau:
Ion X2- có cấu trúc electron: 1s22s22p63s23p6.
Nguyến tố Y có tổng số hạt cơ bản trong nguyên tử là 40. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12.
Ion Z2+ có tổng số hạt mang điện tích dương trong hạt nhân bằng 29.
Vị trí của X, Y, Z trong bảng tuần hoàn lần lượt là:
A. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 29, chu kì 4, nhóm IB).
B. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IA); (Z: ô 29, chu kì 4, nhóm IIB).
C. (X: ô 20, chu kỳ 4, nhóm IIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 29, chu kì 4, nhóm IB).
D. (X: ô 16, chu kỳ 3, nhóm VIA); ( Y: ô 13, chu kì 3, nhóm IIIA); (Z: ô 31, chu kì 4, nhóm IIIA).
Đáp án A
Ion X2- có cấu trúc electron: 1s22s22p63s23p6
X + 2e → X2-
Vậy cấu hình electron của X là 1s22s22p63s23p4
X có 3 lớp electron → X thuộc chu kì 3.
X có số electron = 16 → X thuộc ô 16.
X có 6 electron hóa trị, electron cuối cùng điền vào phân lớp 3p → X thuộc nhóm VIA.
• Nguyên tố Y có tổng số hạt cơ bản trong nguyên tử là 40. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12.
Giả sử số hiệu nguyên tử, số nơtron của Y lần lượt là Z, N
Ta có hpt: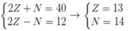
Cấu hình electron của Y là 13Y: 1s22s22p63s23p1
Y có 3 lớp electron → X thuộc chu kì 3.
Y có số electron = 13 → X thuộc ô số 13.
Y có 3 electron hóa trị, electron cuối cùng điền vào phân lớp 3p → Y thuộc nhóm IIIA.
• Ion Z2+ có tổng số hạt mang điện tích dương trong hạt nhân bằng 29.
Z có số hạt mang điện tích dương bằng ion Z2+
Cấu hình electron của Z là 29Z: 1s22s22p63s23p63d104s1
Z thuộc ô số 29.
Z có 4 lớp electron → X thuộc chu kì 4.
Z có electron cuối cùng điền vào phân lớp 3d, có 1 electron hóa trị → Z thuộc nhóm IB.
→ Chọn A.
Đúng 0
Bình luận (0)
Phân tử M2X có tổng số hạt (p, n, e) là 116, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 36. Số khối của nguyên tử X lớn hơn số khối của nguyên tử M là 9. Tổng số hạt (p, n, e) trong ion X2- nhiều hơn tổng số hạt (p, n, e) trong ion M+ là 17. Xác định vị trí của M trong bảng tuần hoàn ?