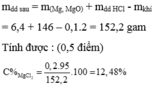Hòa tan 16g MgO vào dung dịch H2SO4 19.6%. Tính nồng độ % của dung dịch thu được sau phản ứng
TH
Những câu hỏi liên quan
Hòa tan 6,5 gam kẽm bằng dung dịch H2SO4 19.6% vừa đủ a)Tính thể tích khí H2 thoát ra (đktc) b) Tính nồng độ % của dung dịch sau phản ứng
a) \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PTHH: Zn + H2SO4 ---> ZnSO4 + H2
0,1--->0,1------->0,1------>0,1
=> \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
b) \(m_{\text{dd}H_2SO_4}=\dfrac{0,1.98}{19,6\%}=50\left(g\right)\)
=> \(m_{\text{dd}.sau.p\text{ư}}=50+6,5-0,1.2=56,3\left(g\right)\)
=> \(C\%_{ZnSO_4}=\dfrac{0,1.161}{56,3}.100\%=28,6\%\)
Đúng 1
Bình luận (0)
Hòa tan 6 gam dung dịch Magie oxit(MgO) vào 50ml dung dịch H2SO4 (có d=1,2g/ml) vừa đủ.
a. Tính khối lượng axit H2SO4 đã phản ứng.
b. Tính nồng độ % ủa dung dịch H2SO4 axit trên.
c. Tính nồng độ % của dung dịch muối sau phản ứng
a)\(n_{MgO}\)=6:40=0,15(mol)
Ta có PTHH:
MgO+\(H_2SO_4\)->MgS\(O_4\)+\(H_2O\)
0,15......0,15...........0,15..................(mol)
Theo PTHH:\(m_{H_2SO_4}\)=0,15.98=14,7g
b)Ta có:\(m_{ddH_2SO_4}\)=D.V=1,2.50=60(g)
=>Nồng độ % dd \(H_2SO_4\) là:
\(C_{\%ddH_2SO_4}\)=\(\dfrac{14,7}{60}\).100%=24,5%
c)Theo PTHH:\(m_{MgSO_4}\)=0,15.120=18(g)
Khối lượng dd sau pư là:
\(m_{ddsau}\)=\(m_{MgO}\)+\(m_{ddH_2SO_4}\)=6+60=66(g)
Vậy nồng độ % dd sau pư là:
\(C_{\%ddsau}\)=\(\dfrac{18}{66}\).100%=27,27%
Đúng 0
Bình luận (1)
câu 1 : trong 400 ml dung dịch có hòa tan 16g CuSO4. Tính nồng độ mol của dung dịch
câu 2 : hòa tan hoàn toàn 3,6g Mg trong dung dịch H2SO4 24,5%
A> Tính thể tích H2 thu đc ở đktc
B> Tsinh nồng độ phần trăm của muối magie sunfat thu đc sau phản ứng
Câu 9: Hòa tan 27 gam N2O5 vào 173 gam dung dịch KOH 28%.
1. Tính khối lượng muối tạo được.
2. Tính nồng độ % từng chất tan có trong dung dịch sau phản ứn
Câu 10: Hòa tan 8 gam MgO vào 100 gam dung dịch HNO3 12,6%. Tính nồng độ % của dung dịch thu được sau phản ứng.
Hòa tan 6,4g hỗn hợp gồm Mg và MgO vào một lượng vừa đủ dung dịch HCl 10% thì thu được 2,24 lít khí (đktc). Tính nồng độ phần trăm của dung dịch thu được sau phản ứng.
Hòa tan hoàn toàn 8,4 gam Fe vào 300ml dung dịch H2SO4 loãng sau phản ứng thu được V lít H2 (đktc) tính V và nồng độ mol/l dung dịch H2SO4 đã phản ứng.
\(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
Pt : \(Fe+H_2SO_4\rightarrow FeSO_4+H_2|\)
1 1 1 1
0,15 0,15 0,15
\(n_{H2}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,15.22,4=3,36\left(l\right)\)
\(n_{H2SO4}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
300ml = 0,3l
\(C_{MddH2SO4}=\dfrac{0,15}{0,3}=0,5\left(M\right)\)
Chúc bạn học tốt
Đúng 1
Bình luận (0)
Hòa tan 49g axit H2SO4 vào nước để tạo thành 150ml dung dịch.a) Tính nồng độ M của dung dịchb) Cho lượng Zn vừa đủ vào dung dịch H2SO4, sau phản ứng thu được dung dịch ZnSO4 và khí H2. Hãy tính thể tích khí H2 thu được ở đktc c) Hãy tính nồng độ phần trăm của ZnSO4 trong dung dịch.(Biết thể tích dung dịch thay đổi không đáng kể, khối lượng riêng của ZnSO4 bằng 1,25 g/ml.Giúp câu c với ạ, cảm ơn~~
Đọc tiếp
Hòa tan 49g axit H2SO4 vào nước để tạo thành 150ml dung dịch.
a) Tính nồng độ M của dung dịch
b) Cho lượng Zn vừa đủ vào dung dịch H2SO4, sau phản ứng thu được dung dịch ZnSO4 và khí H2. Hãy tính thể tích khí H2 thu được ở đktc
c) Hãy tính nồng độ phần trăm của ZnSO4 trong dung dịch.(Biết thể tích dung dịch thay đổi không đáng kể, khối lượng riêng của ZnSO4 bằng 1,25 g/ml.
Giúp câu c với ạ, cảm ơn~~
nH2SO4 = 49/98 = 0.5 (mol)
CMH2SO4 = 0.5/0.15 = 3.3 (M)
Zn + H2SO4 => ZnSO4 + H2
...........0.5.............0.5.........0.5
VH2 = 0.5 * 22.4 = 11.2 (l)
CMZnSO4 = 0.5 / 0.15 = 10/3 (M)
C%ZnSO4 = CM*M / 10D = 10/3 * 161 / 10 * 1.25 = 42.9 %
Đúng 1
Bình luận (1)
hòa tan 15,5g na2o vào nước tạo thành 0,5l dung dịch
a) tính nồng độ mol của dung dịch thu được
b) tính thể tích dung dịch h2so4 20% ( d= 1,24 g/ml) cần dùng để trung hòa dung dịch trên
c) tính nồng độ mol của dung dịch sau phản ứng
Anh bổ sung câu c)
\(C_{MddNa_2SO_4}=\dfrac{0,25}{0,09879+0,5}=0,4175\left(M\right)\)
Đúng 0
Bình luận (0)
Hòa tan 2 gam MgO vào 100 ml dung dịch HCl 20%, sau phản ứng thu được muối MgCl2 và nước. a) Viết phương trình hóa học của phản ứng. b) Tính nồng độ mol MgCl2 thu được sau phản ứng.
Bổ sung: \(D_{HCl}=1,18\left(g/ml\right)\)
a) PTHH: \(MgO+2HCl\rightarrow MgCl_2+H_2O\)
b) Ta có: \(\left\{{}\begin{matrix}n_{MgO}=\dfrac{2}{40}=0,05\left(mol\right)\\n_{HCl}=\dfrac{100\cdot1,18\cdot20\%}{36,5}=\dfrac{236}{365}\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,05}{1}< \dfrac{\dfrac{236}{365}}{2}\) \(\Rightarrow\) HCl còn dư, MgO p/ứ hết
\(\Rightarrow n_{MgCl_2}=0,05\left(mol\right)\) \(\Rightarrow C_{M_{MgCl_2}}=\dfrac{0,05}{0,1}=0,5\left(M\right)\)
Đúng 2
Bình luận (0)