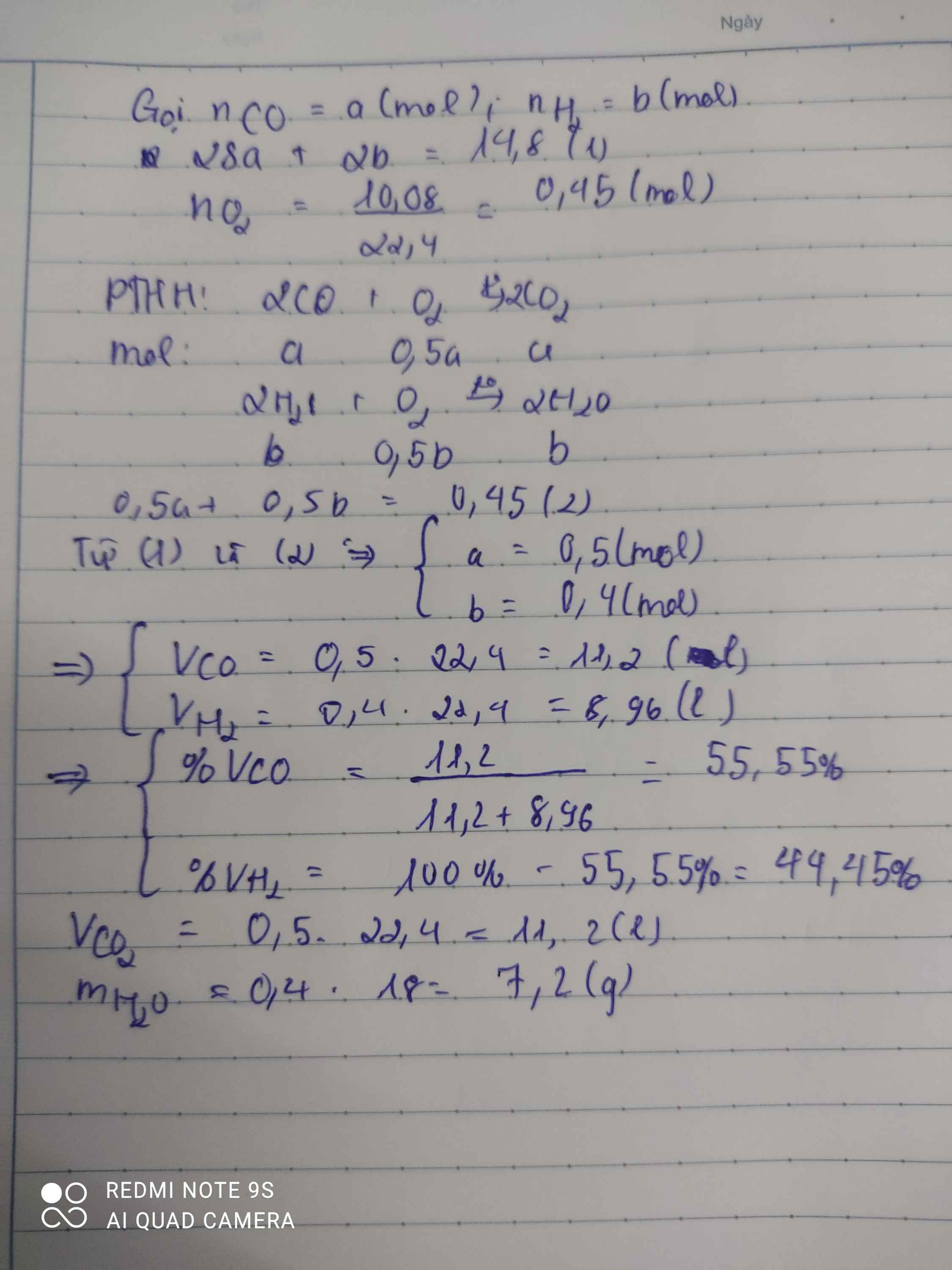15,6 l hỗn hợp gồm 2 khí CO và CO2 có klg là 27,6g.Tính tp % mỗi khí trong hỗn hợp đầu
TA
Những câu hỏi liên quan
Đốt cháy hoàn toàn hỗn hợp khí gồm có CO và H2 cần dùng 9,6 gam khí oxi sinh ra 8,8 gam khí CO2. Tính % theo khối lượng và % theo thể tích của mỗi khí có trong hỗn hợp ban đầu.
\(2CO + O_2 \xrightarrow{t^o} 2CO_2\\ 2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ n_{CO} = n_{CO_2} = \dfrac{8,8}{44} = 0,2(mol)\\ n_{O_2} = \dfrac{n_{CO} + n_{H_2}}{2}=\dfrac{0,2+n_{H_2}}{2} = \dfrac{9,6}{32} = 0,3(mol)\\ \Rightarrow n_{H_2} = 0,4(mol)\\ \%V_{CO} = \dfrac{0,2}{0,2 + 0,4}.100\% = 33,33\%\\ \%V_{H_2} = 100\% - 33,33\% = 66,67\%\\ \%m_{CO} = \dfrac{0,2.28}{0,2.28+0,4.2}.100\%=87,5\%\\ \%m_{H_2} = 100\% - 87,5\% = 12,5\%\)
Đúng 3
Bình luận (0)
Đốt cháy hoàn toàn 14,8 g hỗn hợp khí gồm CO và H2 cần dùng 10,08 l khí O2 Tính:
a. Thành phần % về thể tích mỗi khí trong hỗn hợp ban đầu(đktc)
b. Thể tích khí CO2 và khối lượng nước thu được(đktc)
Đốt cháy hoàn toàn một hỗn hợp khí gồm có CO và H2 cần dùng 9,6g khí oxi . Khí sinh ra có 8,8g CO2 . Phần trăm theo khối lượng của CO trong hỗn hợp khí ban đầu là
nO2 = 9.6/32 = 0.3 (mol)
nCO2 = 8.8/44 = 0.2 (mol)
CO + 1/2O2 -to-> CO2
0.2_____0.1______0.2
H2 + 1/2O2 -to-> H2O
0.4__0.3-0.1
%CO = 0.2*28/(0.2*28 + 0.4*2) * 100% = 87.5%
Chúc bạn học tốt !!!
Đúng 3
Bình luận (1)
Dẫn 11,2 lít (đktc) hỗn hợp X gồm CO và
C
O
2
(có tỉ khối so với
H
2
bằng 15,6) qua ống đựng hỗn hợp chất rắn gồm CuO,
F
e
2
O
3
nung nóng, thu được hỗn hợp khí Y (có tỉ khối so với H2 bằng 18). Khối lượng chất rắn còn lại sau phản ứng đã giảm đi so với ban đầu là A. 1,6 gam B. 3,2 gam C. 2,4 gam D. 4,8 gam
Đọc tiếp
Dẫn 11,2 lít (đktc) hỗn hợp X gồm CO và C O 2 (có tỉ khối so với H 2 bằng 15,6) qua ống đựng hỗn hợp chất rắn gồm CuO, F e 2 O 3 nung nóng, thu được hỗn hợp khí Y (có tỉ khối so với H2 bằng 18). Khối lượng chất rắn còn lại sau phản ứng đã giảm đi so với ban đầu là
A. 1,6 gam
B. 3,2 gam
C. 2,4 gam
D. 4,8 gam
1. Một hỗn hợp khí (X) gồm CO, CO2 và đơn chất (A). Biết % vể thể tích từng khí trong hỗn hợp khí (X) gồm CO, CO2 và đơn chất (A) tương ứng là 40%, 30% và 30%. Trong hỗn hợp khí CO2 chiếm 52,8% về khối lượng hỗn hợp khí (X).a. Tìm công thức hóa học của khí (A). Các khí đo trong cùng điều kiện nhiệt độ và áp suất.b. Có thể thu khí (A) vào bình (từ những thí nghiệm trong phòng thí nghiệm) bằng cách đặt bình thế nào (đứng bình,…)? Vì sao?
Đọc tiếp
1. Một hỗn hợp khí (X) gồm CO, CO2 và đơn chất (A). Biết % vể thể tích từng khí trong hỗn hợp khí (X) gồm CO, CO2 và đơn chất (A) tương ứng là 40%, 30% và 30%. Trong hỗn hợp khí CO2 chiếm 52,8% về khối lượng hỗn hợp khí (X).
a. Tìm công thức hóa học của khí (A). Các khí đo trong cùng điều kiện nhiệt độ và áp suất.
b. Có thể thu khí (A) vào bình (từ những thí nghiệm trong phòng thí nghiệm) bằng cách đặt bình thế nào (đứng bình,…)? Vì sao?
Cho 15,68 lít hỗn hợp gồm hai khí CO và CO2 ở đktc có khối lượng là 27,6 gam. Tính thành phần trăm theo khối lượng mỗi khí trong hỗn hợp.
\(Gọi\ n_{CO} =a(mol) ; n_{CO_2} = b(mol)\\ n_{khí} = a + b = \dfrac{15,68}{22,4} = 0,7(mol)\\ m_{khí} = 28a + 44b = 27,6(gam)\\ \Rightarrow a = 0,2 ; b = 0,5\\ \%m_{CO} = \dfrac{0,2.28}{27,6}.100\% = 20,29\%\\ \%m_{CO_2} = 100\% - 20,29\% = 79,71\%\)
Đúng 1
Bình luận (1)
Đốt cháy hoàn toàn một hỗn hợp khí gồm CO và H2 cần dùng 6,72(l) khí oxi. Khí sinh ra có 4,48(l) khí CO2. Hãy tính thành phần % của hỗn hợp khí ban đầu theo thể tích.
PTHH: \(2CO+O_2\underrightarrow{t^o}2CO_2\) (1)
\(2H_2+O_2\underrightarrow{t^o}2H_2O\) (2)
Ta có: \(\left\{{}\begin{matrix}n_{CO_2}=n_{CO}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\Rightarrow n_{O_2\left(1\right)}=0,1\left(mol\right)\\\Sigma n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{O_2\left(2\right)}=0,2\left(mol\right)\) \(\Rightarrow n_{H_2}=0,4\left(mol\right)\)
\(\Rightarrow\%V_{H_2}=\dfrac{0,4}{0,4+0,2}\cdot100\%\approx66,67\%\)
\(\Rightarrow\%V_{CO}=33,33\%\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn một hỗn hợp khí gồm có CO và H2 cần dùng 7,437 lít khí O2 khí sinh ra có 4,958 lít khí CO2. Thành phần phần trăm theo thể tích của khí H2 trong hỗn hợp bạn đầu là
\(n_{CO_2}=\dfrac{4,958}{24,79}=0,2\left(mol\right)\\ n_{O_2}=\dfrac{7,437}{24,79}=0,3\left(mol\right)\)
PTHH:
2CO + O2 --to--> 2CO2
0,2 0,1 0,2
-> nO2 = 0,3 - 0,1 = 0,2 (mol)
2H2 + O2 --to--> 2H2O
0,4 0,2
\(\rightarrow n_{hhkhí}=0,1+0,4=0,5\left(mol\right)\\ \rightarrow\left\{{}\begin{matrix}\%V_{CO}=\dfrac{0,2}{0,5}=40\%\\\%V_{H_2}=100\%-40\%=60\%\end{matrix}\right.\)
Đúng 4
Bình luận (0)
Cho 5,6 lít hỗn hợp khí X gồm CO và CO2 (đktc). Biết X có tỉ khối so với H2 là 18,8. Tính số mol và % số mol mỗi khí trong hỗn hợp X.
Gọi $n_{CO} = a(mol) ; n_{CO_2} = b(mol)$
Ta có :
$n_X = a + b = 0,25(mol)$
$m_X = 28a + 44b = 18,8.2.0,25 = 9,4(gam)$
$\Rightarrow a = 0,1 ; b = 0,15
$\%n_{CO} = \dfrac{0,1}{0,25}.100\% = 40\%$
$\%n_{CO_2} = 100\% -40\% = 60\%$
Đúng 1
Bình luận (0)