Hãy cho biết nguyên tử trung tâm và phối tử trong các ion phức ở Hình 20.2.

1,Cho các phân tử và ion: NO2, NO2- ,NO2+.
_Hãy cho biết trạng thái lai hóa của nguyên tử trung tâm.
_Dự đoán dạng hình học của chúng .
_Sắp xếp các góc liên kết của chúng
2, cho các chất Cl2O, F2O
So sánh và giải thích các giá trị góc liên kết và độ phân cực của chúng.
3, Cho biết trạng thái lai hóa của nguyên tử trung tâm và dạng hình học của các phân tử ,ion sau :
NCl3 , XeF4 , NH4 , PCl5 , BrF5 , SF5.
Hãy viết cấu hình electron nguyên tử của các nguyên tố sau đây : O, F, Ne. Từ các cấu hình đó hãy cho biết các nguyên tử O, F, mỗi nguyên tử nhận thêm mấy electron thì có cấu hình electron giống như của khí hiếm Ne đứng sau.
Hãy cho biết tại sao các nguyên tử phi kim lại có khuynh hướng nhận thêm electron để trở thành các ion âm ?
O: 1 s 2 2 s 2 2 p 4
F: 1 s 2 2 s 2 2 p 5
Ne: 1 s 2 2 s 2 2 p 6
Từ các cấu hình trên ta dễ dàng thấy rằng nếu nguyên tử F nhận thêm 1e để trở thành ion F - , nguyên tử O nhận thêm 2e để trở thành ion O 2 - thì các ion được hình thành có cấu hình electron giống cấu hình electron của khí hiếm Ne với 8 electron ở lớp ngoài cùng.
Như ta đã biết, cấu hình electron của các khí hiếm với 8 electron (đối với He là 2 electron) ở lớp ngoài cùng là một cấu hình electron vững bền (năng lượng thấp). Vì vậy, các nguyên tử phi kim có khuynh hướng nhận electron để có cấu hình electron vững bền của khí hiếm đứng sau.
Viết cấu hình electron nguyên tử của các nguyên tố sau đây : Al, Mg, Na, Ne. Từ các cấu hình đó hãy cho biết các nguyên tử Al, Mg, Na, mỗi nguyên tử nhường mấy electron thì có cấu hình electron giống như của khí hiếm Ne.
Hãy cho biết tại sao các nguyên tử kim loại lại có khuynh hướng nhường electron để trở thành các ion dương ?
Cấu hình electron của Al, Mg, Na, Ne :
Al 1 s 2 2 s 2 2 p 6 3 s 2 3 p 1 |
Mg 1 s 2 2 s 2 2 p 6 3 s 2 |
Na 1 s 2 2 s 2 2 p 6 3 s 1 |
Ne 1 s 2 2 s 2 2 p 6 |
Từ các cấu hình trên ta dễ dàng thấy rằng nếu :
nguyên tử Na nhường le để trở thành ion Na + ;
nguyên tử Mg nhường 2e để trở thành ion Mg 2 + ;
nguyên tử Al nhường 3e để trở thành ion Al 3 + ,
thì các ion được hình thành có cấu hình electron giống cấu hình electron của khí hiếm Ne với 8 electron ở lớp ngoài cùng.
Ta đã biết cấu hình electron của các khí hiếm với 8 electron (đối với He là electron) ở lớp ngoài cùng là một cấu hình electron vững bền. Vì vậy, các nguyên tử kim loại có khuynh hướng dễ nhường electron để có cấu hình electron vững bền của khí hiếm đứng trước.
Hãy cho biết sự khác nhau về liên kết hoá học trong các tinh thể ion, tinh thể nguyên tử và tinh thể phân tử.
Trong tinh thể ion, liên kết giữa các ion là liên kết ion.
Trong tinh thể nguyên tử, liên kết giữa các nguyên tử là liên kết cộng hoá trị.
Trong tinh thể phân tử, liên kết giữa các phân tử là tương tác yếu, được gọi là tương tác giữa các phân tử.
Hãy cho biết sự khác nhau về các cấu tử (các hạt tạo nên tinh thể) trong tinh thể ion, tinh thể nguyên tử, tinh thể phân tử.
Trong tinh thể ion, các cấu tử là các ion âm và dương. Trong tinh thể nguyên tử, các cấu tử là các nguyên tử. Trong tinh thể phân tử, các cấu từ là các phân tử.
Cấu trúc tinh thể của nguyên tử Cr là lập phương tâm khối (nguyên tử và các ion kim loại chỉ chiếm 68%, còn lại 32% là không gian trống), giả thiết rằng trong tinh thể các nguyên tử Cr là những hình cầu, phần còn lại là các khe rỗng. Khối lượng riêng của Cr là 7,19g/cm3 và nguyên tử khối là 51,9961. Bán kính nguyên tử gần đúng của Cr là
A. 1,25 A 0
B.1,52 A 0
C.1,07 A 0
D.1,17 A 0
Cấu trúc tinh thể của nguyên tử Cr là lập phương tâm khối (nguyên tử và các ion kim loại chỉ chiếm 68%, còn lại 32% là không gian trống), giả thiết rằng trong tinh thể các nguyên tử Cr là những hình cầu, phần còn lại là các khe rỗng. Khối lượng riêng của Cr là 7,19g/cm3 và nguyên tử khối là 51,9961. Bán kính nguyên tử gần đúng của Cr là
![]()
![]()
![]()
![]()
Khi kim loại kết hợp với phi kim thành hợp chất, electron di chuyển từ nguyên tử kim loại sang nguyên tử phi kim. Số electron các nguyên tử kim loại cho đi phải đúng bằng số electron các nguyên tử phi kim nhận được. Khi một nguyên tử nhận thêm electron hay nhường bớt electron, nó trở thành ion. Mô hình sau biểu diễn nguyên tử liti, nguyên tử nito và ion trong hợp chất liti nitrua.

Xác định điện tích của ion liti, ion nito và công thức phân tử của hợp chất liti nitrua
Liti mất 1e (3 – 1 = 2) lớp ngoài cùng nên ion Li mang điện tích +1
Nito thêm 3e (5 + 3 = 8) lớp ngoài cùng nên ion N mang điện tích –5 (N–5)
Công thức phân tử Li3N
Cấu hình electron lớp ngoài cùng của nguyên tử R và ion X2-, Y+ đều là 4s24p6.Hãy viết cấu hình electron nguyên tử R, X, Y và cho biết nguyên tố nào là phi kim, kim loại hay khí hiếm? Vì sao ?
Phát biểu nào dưới đây phù hợp với sơ đồ phản ứng ở Hình 10.1?
(1) Nguyên tử Na nhường, nguyên tử Cl nhận electron để trở thành các ion
(2) Nguyên tử Na và Cl góp chung electron để trở thành các ion
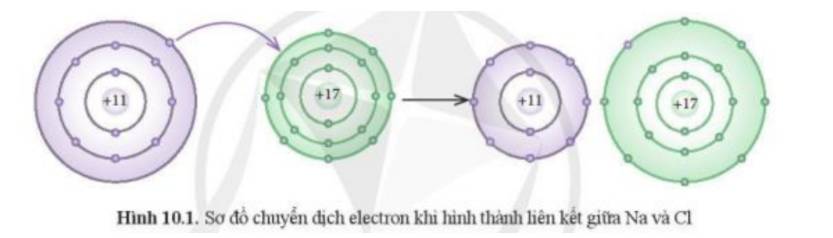
- Theo Hình 10.1 ta thấy:
+ Kim loại Na có 1 electron ở lớp vỏ ngoài cùng => Xu hướng nhường đi 1 electron để đạt cấu hình khí hiếm
+ Phi kim Cl có 7 electron ở lớp vỏ ngoài cùng => Xu hướng nhận thêm 1 electron để đạt cấu hình khí hiếm
=> Cl đã nhận thêm 1 electron từ Na để trở thành các ion
=> Phát biểu (1) phù hợp với sơ đồ phản ứng ở Hình 10.1