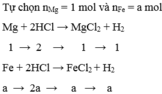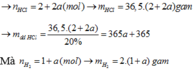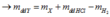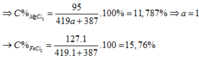hòa tan 4,8g Mg trong 100g dung dịch HCl 36,5% thu được dung dịch A. Tính C% của dung dịch A
HN
Những câu hỏi liên quan
hòa tan 0,02 mol Mg vào 100g dung dịch HCl 36,5%, đến khi phản ứng sảy ra hoàn toàn thu được dung dịch A và khí H2. tính C% của dung dịch A
\(n_{HCl}=\dfrac{100.36,5\%}{100\%}:36,5=1\left(mol\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,02-->0,04----->0,02---->0,02
Xét: \(\dfrac{0,02}{1}< \dfrac{1}{2}\) => HCl dư
A gồm \(\left\{{}\begin{matrix}n_{HCl}=1-0,04=0,06\left(mol\right)\\n_{MgCl_2}=0,02\left(mol\right)\end{matrix}\right.\)
\(m_{dd.A}=0,02.24+100-0,02.2=100,44\left(g\right)\)
\(C\%_{HCl}=\dfrac{0,06.36,5.100\%}{100,44}=2,18\%\)
\(C\%_{MgCl_2}=\dfrac{0,02.95.100\%}{100,44}=1,89\%\)
Đúng 1
Bình luận (0)
hòa tan 10g CaCO3 trong 100g dung dịc HCl 36,5% thu được dung dịch X. Tính C% của dung dịch X
\(m_{HCl}=\dfrac{100.36,5}{100}=36,5\left(g\right)\\ n_{HCl}=\dfrac{36,5}{36,5}=1\left(mol\right)\\ n_{CaCO_3}=\dfrac{10}{100}=0,1\left(mol\right)\\ CaCO_3+2HCl\xrightarrow[]{}CaCl_2+CO_2+H_2O\\ \dfrac{0,1}{1}< \dfrac{1}{2}\Rightarrow HCl.dư\\ n_{CaCO_3}=n_{CaCl_2}=n_{CO_2}=0,1mol\\ m_{CaCl_2}=0,1.111=11,1\left(g\right)\\m_{CO_2}=0,1.44=4,4\left(g\right)\\ m_{ddCaCl_2}=10+100-4,4=105,6\left(g\right)\\ C_{\%CaCl_2}=\dfrac{11,1}{105,6}\cdot100\%\approx10,5\%\)
Đúng 2
Bình luận (0)
hòa tan hoàn toàn 5,12g hỗn hợp X gồm mg và fe trong mg dung dịch hcl 36,5% đến khi phản ứng kết thúc thu được 2,688l H2 dttc và dung dịch Y. để trung hòa hết lượng hcl dư trong Y cần dùng 60ml naoh 1M tính nồng độ % các chất tan trong dung dịch Y.
Đặt \(\left\{{}\begin{matrix}n_{Mg}=n_{MgCl_2}=a\left(mol\right)\\n_{Fe}=n_{FeCl_2}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow24a+56b=5,12\) (1)
Ta có: \(n_{H_2}=\dfrac{2,688}{22,4}=0,12\left(mol\right)\)
Bảo toàn electron: \(2a+2b=0,24\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=n_{MgCl_2}=0,05\left(mol\right)\\b=n_{FeCl_2}=0,07\left(mol\right)\end{matrix}\right.\)
Bảo toàn nguyên tố: \(n_{HCl\left(p/ứ\right)}=2n_{MgCl_2}+2n_{FeCl_2}=0,24\left(mol\right)\)
PTHH: \(NaOH+HCl\rightarrow NaCl+H_2O\)
Theo PTHH: \(n_{HCl\left(dư\right)}=n_{NaOH}=0,06\left(mol\right)\)
\(\Rightarrow\Sigma n_{HCl}=0,3\left(mol\right)\) \(\Rightarrow m_{ddHCl}=\dfrac{0,3\cdot36,5}{36,5\%}=30\left(g\right)\)
Mặt khác: \(m_{H_2}=0,12\cdot2=0,24\left(g\right)\)
\(\Rightarrow m_{dd}=m_{KL}+m_{ddHCl}-m_{H_2}=34,88\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{FeCl_2}=\dfrac{0,07\cdot127}{34,88}\cdot100\%\approx25,49\%\\C\%_{MgCl_2}=\dfrac{0,05\cdot95}{34,88}\cdot100\%\approx13,62\%\\C\%_{HCl\left(dư\right)}=\dfrac{0,04\cdot36,5}{34,88}\cdot100\%\approx4,19\%\end{matrix}\right.\)
Đúng 0
Bình luận (0)
Bài 2: Hòa tan hoàn toàn m gam kim loại Mg cần dùng 200 gam dung dịch HCl vừa đủ được dung dịch A và 4,48 lit khí.
a. Tính m(khối lượng Mg) và C% của dung dịch HCl đã dùng.
b. Tính C% của chất tan trong dung dịch A thu được sau phản ứng.
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
a. PTHH: \(Mg+2HCl--->MgCl_2+H_2\)
Theo PT: \(n_{Mg}=n_{H_2}=0,2\left(mol\right)\)
=> \(m_{Mg}=0,2.24=4,8\left(g\right)\)
Theo PT: \(n_{HCl}=2.n_{Mg}=2.0,2=0,4\left(mol\right)\)
=> \(m_{HCl}=0,4.36.5=14,6\left(g\right)\)
=> \(C_{\%_{HCl}}=\dfrac{14,6}{200}.100\%=7,3\%\)
b. Ta có: \(m_{dd_{MgCl_2}}=4,8+200=204,8\left(g\right)\)
Theo PT: \(n_{MgCl_2}=n_{Mg}=0,2\left(mol\right)\)
=> \(m_{MgCl_2}=0,2.95=19\left(g\right)\)
=> \(C_{\%_{MgCl_2}}=\dfrac{19}{204,8}.100\%=9,28\%\)
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn 4,8g Mg vào dung dịch HCl 10,95% a) Viết phương trình b) Tính khối lượng dung dịch HCl cần dùng c) Tính thể tích khí sinh ra ở đktc d) Tính nồng độ % các chất trong dung dịch tạo thành (Cho : Mg = 24; Cl = 35,5; H = 1
Hòa tan hoàn toàn hỗn hợp (Fe, Mg) bằng dung dịch HCl 20% (vừa đủ) thu được dung dịch A. Trong dung dịch A nồng độ của MgC
l
2
11,787%. Tính C% của
F
e
C
l
2
trong dung dịch A A. 22,22% B. 14,45% C. 24,13%. D. 15,76%.
Đọc tiếp
Hòa tan hoàn toàn hỗn hợp (Fe, Mg) bằng dung dịch HCl 20% (vừa đủ) thu được dung dịch A. Trong dung dịch A nồng độ của MgC l 2 = 11,787%. Tính C% của F e C l 2 trong dung dịch A
A. 22,22%
B. 14,45%
C. 24,13%.
D. 15,76%.
Câu 3 : Hòa tan hoàn toàn 4,8g Mg vào dung dịch HCl 10,95%
a) Viết phương trình
b) Tính khối lượng dung dịch HCl cần dùng
c) Tính thể tích khí sinh ra ở đktc
d) Tính nồng độ % các chất trong dung dịch tạo thành
Câu 3 :
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
a) Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
0,2 0,4 0,2 0,2
b) \(n_{HCl}=\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
\(m_{HCl}=0,4.36,5=14,6\left(g\right)\)
\(m_{ddHCl}=\dfrac{14,6.100}{10,95}=133,3\left(g\right)\)
c) \(n_{H2}=\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
d) \(n_{MgCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{MgCl2}=0,2.95=19\left(g\right)\)
\(m_{ddspu}=4,8+133,3-\left(0,2.2\right)=137,7\left(g\right)\)
\(C_{MgCl2}=\dfrac{19.100}{137,7}=13,8\)0/0
Chúc bạn học tốt
Đúng 2
Bình luận (0)
Tính C% chất tan trong dung dịch thu được trong các trường hợp sau:
a. Trộn 100 gam dung dịch HCl 10% với 150 gam dung dịch HCl 20%.
b. Hòa tan hoàn toàn 2,4 gam Mg bằng 100 gam dung dịch HCl 10,95%
\(a.m_{HCl}=100.10\%+150.20\%=40\left(g\right)\\ C\%_{ddHCl}=\dfrac{40}{100+150}.100=16\%\\ b.n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\\ n_{HCl}=\dfrac{10,95\%.100}{36,5}=0,3\left(mol\right)\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ Vì:\dfrac{0,1}{1}< \dfrac{0,3}{1}\Rightarrow HCldư\\ n_{HCl\left(dư\right)}=0,3-2.0,1=0,1\left(mol\right)\\ m_{HCl\left(dư\right)}=0,1.36,5=3,65\left(g\right)\\ n_{MgCl_2}=n_{Mg}=0,1\left(mol\right)\\ m_{MgCl_2}=0,1.95=9,5\left(g\right)\\ m_{ddsau}=2,4+100-0,1.2=102,2\left(g\right)\\ C\%_{ddHCl\left(dư\right)}=\dfrac{3,65}{102,2}.100\approx3,571\%\)
\(C\%_{ddMgCl_2}=\dfrac{9,5}{102,2}.100\approx9,295\%\)
Đúng 1
Bình luận (0)
Hòa tan hoàn 4,8g kim loại hóa trị 2 trong dung dịch HCL sau phản ứng thu được dung dịch A và V lít khí H2 điều kiện tính chất.Cô cạn dung dịch A thu được 1g muối khun 1.Tính V 2.Xác định kim loại
a, Gọi KL cần tìm là A.
\(A+2HCl\rightarrow ACl_2+H_2\)
Ta có: \(n_A=\dfrac{4,8}{M_A}\left(mol\right)\), \(n_{ACl_2}=\dfrac{1}{M_A+71}\left(mol\right)\)
Theo PT: \(n_A=n_{ACl_2}\Rightarrow\dfrac{4,8}{M_A}=\dfrac{1}{M_A+71}\Rightarrow M_A=-89,68\)
→ vô lý
Bạn xem lại đề nhé.
Đúng 0
Bình luận (0)