tính trong 98(g) H2SO4 có bao nhiêu phân tử H2SO4
H24
Những câu hỏi liên quan
Tính nồng độ mol của dung dịch H2SO4 98% (D = 1,84 g/ml). Từ 50 ml dung dịch H2SO4 98%, có thể điều chế được bao nhiêu gam dung dịch H2SO4 10%?
- Giả sử có 100 gam dd H2SO4 98%
\(m_{H_2SO_4}=\dfrac{100.98}{100}=98\left(g\right)\) => \(n_{H_2SO_4}=\dfrac{98}{98}=1\left(mol\right)\)
\(V_{dd.H_2SO_4.98\%}=\dfrac{100}{1,84}=\dfrac{1250}{23}\left(ml\right)=\dfrac{5}{92}\left(l\right)\)
\(C_{M\left(dd.H_2SO_4.98\%\right)}=\dfrac{1}{\dfrac{5}{92}}=18,4M\)
-
\(n_{H_2SO_4}=18,4.0,05=0,92\left(mol\right)\)
=> \(m_{H_2SO_4}=0,92.98=90,16\left(g\right)\)
=> \(m_{dd.H_2SO_4.10\%}=\dfrac{90,16.100}{10}=901,6\left(g\right)\)
Đúng 2
Bình luận (0)
Trong phản ứng: Fe + H2SO4 đặc
→
t
o
Fe2(SO4)3 + SO2 + H2O có bao nhiêu nguyên tử Fe bị oxi hóa và bao nhiêu phân tử H2SO4 bị khử? A. 1 và 1 B. 2 và 3 C. 3 và 2. D. 2 và 6.
Đọc tiếp
Trong phản ứng: Fe + H2SO4 đặc → t o Fe2(SO4)3 + SO2 + H2O có bao nhiêu nguyên tử Fe bị oxi hóa và bao nhiêu phân tử H2SO4 bị khử?
A. 1 và 1
B. 2 và 3
C. 3 và 2.
D. 2 và 6.
Đáp án B
2Fe + 6H2SO4 đặc → Fe2(SO4)3 + 3SO2 + 6H2O
Số nguyên tử Fe bị oxi hóa thành Fe2(SO4)3 là 2 và số phân tử H2SO4 bị khử thành SO2 là 3.
=> Chọn B.
Đúng 0
Bình luận (0)
Trong phản ứng: Fe + H2SO4 đặc
→
t
o
Fe2(SO4)3 + SO2 + H2O có bao nhiêu nguyên tử Fe bị oxi hóa và bao nhiêu phân tử H2SO4 bị khử? A. 1 và 1. B. 2 và 3. C. 3 và 2. D. 2 và 6.
Đọc tiếp
Trong phản ứng: Fe + H2SO4 đặc → t o Fe2(SO4)3 + SO2 + H2O có bao nhiêu nguyên tử Fe bị oxi hóa và bao nhiêu phân tử H2SO4 bị khử?
A. 1 và 1.
B. 2 và 3.
C. 3 và 2.
D. 2 và 6.
Đáp án B
2Fe + 6H2SO4 đặc → Fe2(SO4)3 + 3SO2 + 6H2O
Số nguyên tử Fe bị oxi hóa thành Fe2(SO4)3 là 2 và số phân tử H2SO4 bị khử thành SO2 là 3.
Đúng 0
Bình luận (0)
Bài 10: Tính nồng độ mol của dung dịch H2SO4 98% (D 1,84 g/ml). Từ 50 ml dung dịch H2SO4 98%, có thể điều chế được bao nhiêu gam dung dịch H2SO4 10%?Bài 11: Hòa tan x gam hỗn hợp gồm Al và Zn vào y gam dung dịch H2SO4 10%. Sau phản ứng thu được dung dịch có 3 chất tan với nồng độ % bằng nhau.a/ Tính tỉ lệ khối lượng 2 kim loại trong hỗn hợp.b/ Tìm x, y biết sau phản ứng thu được 11,2 lít H2 (đktc).
Đọc tiếp
Bài 10: Tính nồng độ mol của dung dịch H2SO4 98% (D = 1,84 g/ml). Từ 50 ml dung dịch H2SO4 98%, có thể điều chế được bao nhiêu gam dung dịch H2SO4 10%?
Bài 11: Hòa tan x gam hỗn hợp gồm Al và Zn vào y gam dung dịch H2SO4 10%. Sau phản ứng thu được dung dịch có 3 chất tan với nồng độ % bằng nhau.
a/ Tính tỉ lệ khối lượng 2 kim loại trong hỗn hợp.
b/ Tìm x, y biết sau phản ứng thu được 11,2 lít H2 (đktc).
Bài 10:
- Giả sử có 100 gam dd H2SO4 98%
\(m_{H_2SO_4}=\dfrac{100.98}{100}=98\left(g\right)\) => \(n_{H_2SO_4}=\dfrac{98}{98}=1\left(mol\right)\)
\(V_{dd.H_2SO_4.98\%}=\dfrac{100}{1,84}=\dfrac{1250}{23}\left(ml\right)=\dfrac{5}{92}\left(l\right)\)
\(C_{M\left(dd.H_2SO_4.98\%\right)}=\dfrac{1}{\dfrac{5}{92}}=18,4M\)
\(n_{H_2SO_4}=18,4.0,05=0,92\left(mol\right)\)
=> \(m_{H_2SO_4}=0,92.98=90,16\left(g\right)\)
=> \(m_{dd.H_2SO_4.10\%}=\dfrac{90,16.100}{10}=901,6\left(g\right)\)
Bài 11:
a) Do dd sau pư có 3 chát tan với nồng độ % bằng nhau
=> \(m_{Al_2\left(SO_4\right)_3}=m_{ZnSO_4}=m_{H_2SO_4\left(dư\right)}\)
Gọi số mol Al, Zn là a, b (mol)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
a----->1,5a------->0,5a----->1,5a
Zn + H2SO4 --> ZnSO4 + H2
b----->b--------->b----->b
=> \(\left\{{}\begin{matrix}m_{Al_2\left(SO_4\right)_3}=342.0,5a=171a\left(g\right)\\m_{ZnSO_4}=161b\left(g\right)\end{matrix}\right.\)
=> 171a = 161b
=> \(\dfrac{a}{b}=\dfrac{161}{171}\) (1)
Có: \(\dfrac{m_{Al}}{m_{Zn}}=\dfrac{27.n_{Al}}{65.n_{Zn}}=\dfrac{27}{65}.\dfrac{161}{171}=\dfrac{483}{1235}\)
b) \(n_{H_2}=1,5a+b=\dfrac{11,2}{22,4}=0,5\left(mol\right)\) (2)
(1)(2) => \(\left\{{}\begin{matrix}a=\dfrac{161}{825}\left(mol\right)\\b=\dfrac{57}{275}\left(mol\right)\end{matrix}\right.\)
=> \(x=\dfrac{161}{825}.27+\dfrac{57}{275}.65=\dfrac{5154}{275}\left(g\right)\)
\(m_{H_2SO_4\left(dư\right)}=m_{Al_2\left(SO_4\right)_3}=342.0,5\dfrac{161}{825}=\dfrac{9177}{275}\left(g\right)\)
=> \(m_{H_2SO_4\left(bđ\right)}=98\left(1,5a+b\right)+\dfrac{9177}{275}=\dfrac{22652}{275}\left(g\right)\)
=> \(y=\dfrac{\dfrac{22652}{275}.100}{10}=\dfrac{45304}{55}\left(g\right)\)
Đúng 3
Bình luận (0)
Trong phản ứng: Fe + H2SO4 đặc
→
t
°
Fe2(SO4)3 + SO2 + H2O có bao nhiêu nguyên tử Fe bị oxi hóa và bao nhiêu phân tử H2SO4 bị khử? A. 1 và 1 B. 2 và 3. C. 3 và 2 D. 2 và 6.
Đọc tiếp
Trong phản ứng: Fe + H2SO4 đặc → t ° Fe2(SO4)3 + SO2 + H2O có bao nhiêu nguyên tử Fe bị oxi hóa và bao nhiêu phân tử H2SO4 bị khử?
A. 1 và 1
B. 2 và 3.
C. 3 và 2
D. 2 và 6.
Chọn B
2Fe + 6H2SO4 đặc → t ° Fe2(SO4)3 + 3SO2 + 6H2O
Số nguyên tử Fe bị oxi hóa thành Fe2(SO4)3 là 2 và số phân tử H2SO4 bị khử thành SO2 là 3.
Đúng 0
Bình luận (0)
1.Trong 9,8g H2SO4 có bao nhiêu phân tử H2SO4 ?2.Cho sơ đồ phản ứng: Giá trị thích hợp của a, b, c, d lần lượt là3.Số mol phân tử O2 có trong 320g Oxi là: Mọi người giúp em ạ
Đọc tiếp
1.Trong 9,8g H2SO4 có bao nhiêu phân tử H2SO4 ?
2.
Cho sơ đồ phản ứng:
Giá trị thích hợp của a, b, c, d lần lượt là
3.Số mol phân tử O2 có trong 320g Oxi là:
Mọi người giúp em ạ
\(1,n_{H_2SO_4}=\dfrac{9,8}{98}=0,1(mol)\\ \Rightarrow \text{Số phân tử }H_2SO_4=0,1.6.10^{23}=0,6.10^{23}\\ 2,2Fe(OH)_2+3H_2SO_4\to Fe_2(SO_4)_3+6H_2O\\ \Rightarrow a=2;b=3;c=1;d=6\\ 3,n_{O_2}=\dfrac{320}{32}=10(mol)\)
Đúng 1
Bình luận (0)
Biết rằng, kim loại nhôm tác dụng với axit sunfuric
H
2
S
O
4
tạo ra chat nhôm sunfat
A
l
2
S
O
4
3
và khí hidro. Nếu có
6
,
02
.
10
23
nguyên tử Al sẽ tác dụn...
Đọc tiếp
Biết rằng, kim loại nhôm tác dụng với axit sunfuric H 2 S O 4 tạo ra chat nhôm sunfat A l 2 S O 4 3 và khí hidro. Nếu có 6 , 02 . 10 23 nguyên tử Al sẽ tác dụng được với bao nhiêu phân tử H 2 S O 4 tạo ra bao nhiêu phân tử A l 2 S O 4 3 và bao nhiêu phân tử H 2 ?
Nếu có có 6 , 02 . 10 23 nguyên tử Al sẽ tác dụng với:
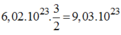 phân tử
H
2
S
O
4
phân tử
H
2
S
O
4
Và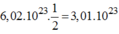 phân tử
A
l
2
S
O
4
3
phân tử
A
l
2
S
O
4
3
Tạo ra: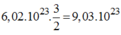 phân tử
H
2
phân tử
H
2
Đúng 0
Bình luận (0)
Có 100 ml H2SO4 98% , khối lượng riêng là 1,84 g/ml. Nếu muốn pha loãng thể tích H2SO4 trên thành dung dịch H2SO4 20% thì cần thêm vào bao nhiêu ml nước? Bồ ơi giúp với❤
\(C\%_{sau}=0,2=\dfrac{100.1,84.0,98}{100.1,84+V_{H_2O}}\\ V_{H_2O}=717,6mL\)
Đúng 1
Bình luận (0)
Trong phản ứng:
Fe
+
H
2
SO
4
đ
→
t
0
Fe
2
(
SO
4
)
3
+
H
2
O
+
SO
2
có bao nhiêu nguyên tử Fe bị oxi hóa và bao nhiêu phân tử H2SO4 bị khử? A. 2 v...
Đọc tiếp
Trong phản ứng: Fe + H 2 SO 4 đ → t 0 Fe 2 ( SO 4 ) 3 + H 2 O + SO 2 có bao nhiêu nguyên tử Fe bị oxi hóa và bao nhiêu phân tử H2SO4 bị khử?
A. 2 và 3
B. 1 và 1
C. 3 và 2
D. 2 và 6
Từ dung dịch H2SO4 98% có d = 1.84 g/ml. Cần bao nhiêu lít dung dịch trên để pha thành 1L dung dịch H2SO4 5M. Lấy 100ml dung dịch H2SO4 5M trên sau đó cho vào 750ml nước. Xác định nồng độ dung dịch H2SO4 vừa pha.






