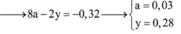Hỗn hợp X nặng 11,7 gam gồm hai kim loại A và B. Trong hỗn hợp X, tổng số mol 2 kim loại là 0,5; số nguyên tử A gấp rưỡi số nguyên tử B. a/ Tìm số mol mỗi kim loại. b/ Biết A và B có nguyên tử khối hơn kém nhau 1 đvC. Xác định tên của A, B.
AT
Những câu hỏi liên quan
Hỗn hợp X nặng 13,6 gam gồm hai kim loại A và B. Trong hỗn hợp X, tổng số nguyên tử của 2 kim loại là 2,4.1023 nguyên tử; số nguyên tử A gấp ba lần số nguyên tử B.a/ Tìm số mol mỗi kim loại.b/ Biết MB : MA 8 : 3. Xác định tên A, B.c/ Cho 6,8 gam hỗn hợp X phản ứng với khí clo.- Tính thể tích Cl2 (đktc) cần dùng.- Tính tổng khối lượng sản phẩm thu được
Đọc tiếp
Hỗn hợp X nặng 13,6 gam gồm hai kim loại A và B. Trong hỗn hợp X, tổng số nguyên tử của 2 kim loại là 2,4.1023 nguyên tử; số nguyên tử A gấp ba lần số nguyên tử B.
a/ Tìm số mol mỗi kim loại.
b/ Biết MB : MA = 8 : 3. Xác định tên A, B.
c/ Cho 6,8 gam hỗn hợp X phản ứng với khí clo.
- Tính thể tích Cl2 (đktc) cần dùng.
- Tính tổng khối lượng sản phẩm thu được
a, Gọi \(n_B=a\left(mol\right)\rightarrow n_A=3a\left(mol\right)\)
Theo đề bài: \(a+3a=\dfrac{2,4.10^{23}}{6.10^{23}}=0,4\left(mol\right)\)
\(\Leftrightarrow a=0,1\left(mol\right)\)
b, Gọi \(M_B=b\left(\dfrac{g}{mol}\right)\rightarrow M_A=0,375b\left(\dfrac{g}{mol}\right)\)
Theo đề bài: \(0,1b+0,3.0,375b=13,6\)
\(\Leftrightarrow b=64\left(\dfrac{g}{mol}\right)\\ \rightarrow\left\{{}\begin{matrix}M_B=64\left(\dfrac{g}{mol}\right)\\M_A=\dfrac{3}{8}.64=24\left(\dfrac{g}{mol}\right)\end{matrix}\right.\)
=> A và B lần lượt là Cu và Mg
c, \(\left\{{}\begin{matrix}n_{Cu}=\dfrac{6,8}{13,6}.0,3=0,15\left(mol\right)\\n_{Mg}=\dfrac{0,15}{3}=0,05\left(mol\right)\end{matrix}\right.\)
PTHH: Cu + Cl2 --to--> CuCl2
0,15 -> 0,15
Mg + Cl2 --to--> MgCl2
0,05 -> 0,05
\(V_{Cl_2}=\left(0,05+0,15\right).22,4=4,48\left(l\right)\)
Đúng 2
Bình luận (0)
Hỗn hợp X có khối lượng 23,8g gồm hai kim loại là Al và Zn trong hỗn hợp là 2 : 1. a) Tính số mol trong mỗi kim loại trong hỗn hợp X b) Tính khối lượng mỗi kim loại trong hỗn hợp
a)Gọi $n_{Al} =2 a(mol) ; n_{Zn} = a(mol) \Rightarrow 2a.27 + 65a = 23,8$
$\Rightarrow a = 0,2(mol)$
Suy ra : $n_{Al} = 0,4(mol) ; n_{Zn} = 0,2(mol)$
b) $m_{Al} = 0,4.27 = 10,8(gam) ; m_{Zn} = 0,2.65 = 13(gam)$
Đúng 1
Bình luận (0)
Cho 3,6 g hỗn hợp X gồm K và 1 kim loại kiềm M tác dụng vừa hết với nước, thu đc 2,24 lít H2 ở 0,5 atm và 0 độ C . Biết số mol kim loại M trong hỗn hợp lớn hơn 10% tổng số mol 2 kim loại . Xác định kim loại M
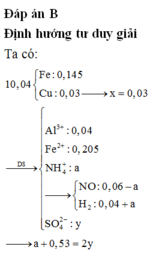
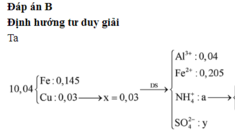
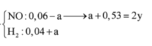
Cho hỗn hợp gồm 0,04 mol Al và 0,35 mol Fe tác dụng với dd chứa hỗn hợp gồm x mol Cu(NO3)2 và y mol H2SO4, thu được 2,24 lít (đktc) hỗn hợp hai khí (gồm NO và H2), dung dịch chứa m gam muối và 10,04 gam hỗn hợp hai kim loại (trong đó kim loại mạnh hơn chiếm 80,88% khối lượng). Giá trị của (y – x ) là A. 0,26 B. 0,25 C. 0,23 D. 0,22
Đọc tiếp
Cho hỗn hợp gồm 0,04 mol Al và 0,35 mol Fe tác dụng với dd chứa hỗn hợp gồm x mol Cu(NO3)2 và y mol H2SO4, thu được 2,24 lít (đktc) hỗn hợp hai khí (gồm NO và H2), dung dịch chứa m gam muối và 10,04 gam hỗn hợp hai kim loại (trong đó kim loại mạnh hơn chiếm 80,88% khối lượng). Giá trị của (y – x ) là
A. 0,26
B. 0,25
C. 0,23
D. 0,22
Cho hỗn hợp gồm 0,04 mol Al và 0,35 mol Fe tác dụng với dd chứa hỗn hợp gồm x mol Cu(NO3)2 và y mol H2SO4, thu được 2,24 lít (đktc) hỗn hợp hai khí (gồm NO và H2), dung dịch chứa m gam muối và 10,04 gam hỗn hợp hai kim loại (trong đó kim loại mạnh hơn chiếm 80,88% khối lượng). Giá trị của (y – x ) là A. 0,26. B. 0,25. C. 0,23. D. 0,22.
Đọc tiếp
Cho hỗn hợp gồm 0,04 mol Al và 0,35 mol Fe tác dụng với dd chứa hỗn hợp gồm x mol Cu(NO3)2 và y mol H2SO4, thu được 2,24 lít (đktc) hỗn hợp hai khí (gồm NO và H2), dung dịch chứa m gam muối và 10,04 gam hỗn hợp hai kim loại (trong đó kim loại mạnh hơn chiếm 80,88% khối lượng). Giá trị của (y – x ) là
A. 0,26.
B. 0,25.
C. 0,23.
D. 0,22.
Cho 33,6 gam hỗn hợp A gồm 2 kim loại Mg và X (chưa biết) có tỉ lệ số mol tương ứng là 2 : 3. Khối lượng Mg bằng khối lượng Mg có trong 16 gam MgO. a/ Tính khối lượng Mg trong hỗn hợp A. b/ Tính số mol X có trong hỗn hợp A, từ đó tìm kim loại X. c/ Đốt cháy hoàn toàn 33,6 gam hỗn hợp A trong không khí, thu được 49,6 gam hỗn hợp sản phẩm. - Viết PTHH. - Tính khối lượng khí oxi cần dùng cho phản ứng. - Tính thể tích không khí (đktc) cần dùng biết O2 chiếm 20% thể tích không khí.
Đọc tiếp
Cho 33,6 gam hỗn hợp A gồm 2 kim loại Mg và X (chưa biết) có tỉ lệ số mol tương ứng là 2 : 3. Khối lượng Mg bằng khối lượng Mg có trong 16 gam MgO.
a/ Tính khối lượng Mg trong hỗn hợp A.
b/ Tính số mol X có trong hỗn hợp A, từ đó tìm kim loại X.
c/ Đốt cháy hoàn toàn 33,6 gam hỗn hợp A trong không khí, thu được 49,6 gam hỗn hợp sản phẩm.
- Viết PTHH.
- Tính khối lượng khí oxi cần dùng cho phản ứng.
- Tính thể tích không khí (đktc) cần dùng biết O2 chiếm 20% thể tích không khí.
a) \(n_{MgO}=\dfrac{16}{40}=0,4\left(mol\right)\)
=> nMg = 0,4 (mol)
=> mMg = 0,4.24 = 9,6 (g)
b)
Có: nMg : nX = 2 : 3
Mà nMg = 0,4 (mol)
=> nX = 0,6 (mol)
mX = 33,6 - 9,6 = 24 (g)
=> \(M_X=\dfrac{24}{0,6}=40\left(g/mol\right)\)
=> X là Ca
c)
PTHH: 2Mg + O2 --to--> 2MgO
0,4->0,2
2Ca + O2 --to--> 2CaO
0,6->0,3
=> \(m_{O_2}=\left(0,2+0,3\right).32=16\left(g\right)\)
\(V_{O_2}=\left(0,2+0,3\right).22,4=11,2\left(l\right)\)
=> Vkk = 11,2.5 = 56 (l)
Đúng 4
Bình luận (0)
a) MX=240,6=40(g/mol)MX=240,6=40(g/mol)
=> X là Ca
c PTHH: 2Mg + O2 --to--> 2MgO
0,4->0,2
2Ca + O2 --to--> 2CaO
0,6->0,3
=> mO2=(0,2+0,3).32=16(g)mO2=(0,2+0,3).32=16(g)
VO2=(0,2+0,3).22,4=11,2(l)VO2=(0,2+0,3).22,4=11,2(l)
=> Vkk = 11,2.5 = 56 (l)
Đúng 1
Bình luận (0)
Đem nung hỗn hợp X gồm hai kim loại: a mol Fe và 0,15 mol Cu trong không khí một thời gian thu được 63,2 gam hỗn hợp Y gồm 2 kim loại trên và hỗn hợp các oxit của chúng. Đem hòa tan hết lượng hỗn hợp Y trên bằng dung dịch HNO3 đậm đặc thì thu được 0,2 mol NO. Trị số của a là: A. 0,64 mol B. 0,60 mol C. 0,70 mol D. 0,67 mol
Đọc tiếp
Đem nung hỗn hợp X gồm hai kim loại: a mol Fe và 0,15 mol Cu trong không khí một thời gian thu được 63,2 gam hỗn hợp Y gồm 2 kim loại trên và hỗn hợp các oxit của chúng. Đem hòa tan hết lượng hỗn hợp Y trên bằng dung dịch HNO3 đậm đặc thì thu được 0,2 mol NO. Trị số của a là:
A. 0,64 mol
B. 0,60 mol
C. 0,70 mol
D. 0,67 mol
Fe, Cu + O2 → hỗn hợp rắn X
Theo ĐL Bảo toàn khối lượng có mO2= 63,2-56a-0,15.64= 53,6-56a (gam) → nO2= (53,6-56a)/32 mol
Ta có nNO= 0,2 mol
QT cho e:
Fe→ Fe3++ 3e
a 3amol
Cu → Cu2++ 2e
0,15 0,3
QT nhận e :
O2+ 4e→ 2O-2
(53,6-56a)/32 (53,6-56a)/8
N+5+ 3e → NO
0,6←0,2
Theo ĐL BT electron thì : ne cho= ne nhận
Nên 3a+ 0,3= (53,6-56a)/8+ 0,6 Suy ra a= 0,7
Đáp án C
Đúng 0
Bình luận (0)
Câu 5: Cho 33,6 gam hỗn hợp A gồm 2 kim loại Mg và X (chưa biết) có tỉ lệ số mol tương ứng là 2 : 3. Khối lượng Mg bằng khối lượng Mg có trong 16 gam MgO.a/ Tính khối lượng Mg trong hỗn hợp A.b/ Tính số mol X có trong hỗn hợp A, từ đó tìm kim loại X.c/ Đốt cháy hoàn toàn 33,6 gam hỗn hợp A trong không khí, thu được 49,6 gam hỗn hợp sản phẩm.- Viết PTHH.- Tính khối lượng khí oxi cần dùng cho phản ứng.- Tính thể tích không khí (đktc) cần dùng biết O2 chiếm 20% thể tích không khí.
Đọc tiếp
Câu 5: Cho 33,6 gam hỗn hợp A gồm 2 kim loại Mg và X (chưa biết) có tỉ lệ số mol tương ứng là 2 : 3. Khối lượng Mg bằng khối lượng Mg có trong 16 gam MgO.
a/ Tính khối lượng Mg trong hỗn hợp A.
b/ Tính số mol X có trong hỗn hợp A, từ đó tìm kim loại X.
c/ Đốt cháy hoàn toàn 33,6 gam hỗn hợp A trong không khí, thu được 49,6 gam hỗn hợp sản phẩm.
- Viết PTHH.
- Tính khối lượng khí oxi cần dùng cho phản ứng.
- Tính thể tích không khí (đktc) cần dùng biết O2 chiếm 20% thể tích không khí.
a) \(n_{MgO}=\dfrac{16}{40}=0,4\left(mol\right)\)
=> nMg = 0,4 (mol)
=> mMg = 0,4.24 = 9,6 (g)
b) nMg = 0,4 (mol) => nX = 0,6 (mol)
mX = 33,6 - 9,6 = 24 (g)
=> \(M_X=\dfrac{24}{0,6}=40\left(g/mol\right)\)
=> X là Ca
c)
PTHH: 2Mg + O2 --to--> 2MgO
2Ca + O2 --to--> 2CaO
\(m_{O_2}=49,6-33,6=16\left(g\right)\)
=> \(n_{O_2}=\dfrac{16}{32}=0,5\left(mol\right)\)
=> VO2 = 0,5.22,4 = 11,2 (l)
=> Vkk = 11,2.5 = 56 (l)
Đúng 4
Bình luận (1)
a)\(n_{MgO}=\dfrac{16}{40}=0,4mol\Rightarrow n_{Mg}=0,4mol\Rightarrow m_{Mg}=9,6g\)
\(\Rightarrow m_X=33,6-9,6=24g\)
b)Theo bài: \(\dfrac{n_{Mg}}{n_X}=\dfrac{2}{3}\Rightarrow\dfrac{0,4}{n_X}=\dfrac{2}{3}\Rightarrow n_X=0,6mol\)
\(\Rightarrow M_X=\dfrac{24}{0,6}=40\Rightarrow X:Ca\)
c)\(2Mg+O_2\underrightarrow{t^o}2MgO\)
\(x\) \(x\)
\(2Ca+O_2\underrightarrow{t^o}2CaO\)
\(y\) \(y\)
\(\Rightarrow\left\{{}\begin{matrix}24x+40y=33,6\\40x+56y=49,6\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,4\\y=0,6\end{matrix}\right.\)
\(\Sigma n_{O_2}=\dfrac{1}{2}n_{Mg}+\dfrac{1}{2}n_{Ca}=0,2+0,3=0,5mol\)
\(m_{O_2}=0,5\cdot32=16g\)
\(V_{kk}=5V_{O_2}=5\cdot0,5\cdot22,4=56l\)
Đúng 1
Bình luận (0)
Một hỗn hợp có khối lượng 7,8 gam gồm 2 kim loại nhôm và magie biết tỉ lệ số mol nhôm và magie là 2/1
a, Tính số mol mỗi kim loại trong hỗn hợp
b, Tính khối lượng kim loại trong hỗn hợp
a, Ta có : \(\dfrac{n_{Al}}{n_{Mg}}=\dfrac{2}{1}\)
Mà \(m_{hh}=m_{Al}+m_{Mg}=27n_{Al}+24n_{Mg}=7,8\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,2\\n_{Mg}=0,1\end{matrix}\right.\) mol
b, Ta có : \(\left\{{}\begin{matrix}m_{Al}=n.M=5,4\\m_{Mg}=n.M=2,4\end{matrix}\right.\) g
Vậy ...
Đúng 1
Bình luận (0)