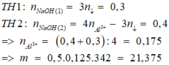Hòa tan a gam Na2O vào m gam H2O thu được 400 gam dd NaOH 1,15%.Tính a,m
NC
Những câu hỏi liên quan
a, Cho m gam bột sắt vào dd HCl dư. Sau phản ứng thu được 3,36 lít khí ở đktc. Tính gtri của m.
b, Hòa tan hoàn toàn 6,2 gam Na2O vào nước dư thu được 500ml dd A. Tính nồng độ mol của dd A.
a, \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{Fe}=n_{H_2}=0,15\left(mol\right)\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
b, \(n_{Na_2O}=\dfrac{6,2}{62}=0,1\left(mol\right)\)
\(Na_2O+H_2O\rightarrow2NaOH\)
\(n_{NaOH}=2n_{Na_2O}=0,2\left(mol\right)\Rightarrow C_{M_{NaOH}}=\dfrac{0,2}{0,5}=0,4\left(M\right)\)
Đúng 2
Bình luận (0)
\(a,n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,15 0,3 0,15 0,15
\(m_{Fe}=0,15.56=8,4\left(g\right)\)
\(a,n_{Na_2O}=\dfrac{6,2}{62}=0,1\left(mol\right)\)
PTHH :
\(Na_2O+H_2O\rightarrow2NaOH\)
0,1 0,1 0,2
\(C_{M\left(A\right)}=\dfrac{0,2}{0,5}=0,4\left(M\right)\)
Đúng 2
Bình luận (0)
Hoà tan hết m gam Al2(SO4)3 vào nước được dd A. Cho 300 ml dung dịch NaOH 1M vào A, thu được a gam kết tủa. Mặc khác, nếu cho 400 ml dung dịch NaOH 1M vào A, cũng thu được a gam kết tủa. Giá trị của m là A. 21.375 B. 42.75 C. 17.1 D. 22.8
Đọc tiếp
Hoà tan hết m gam Al2(SO4)3 vào nước được dd A. Cho 300 ml dung dịch NaOH 1M vào A, thu được a gam kết tủa. Mặc khác, nếu cho 400 ml dung dịch NaOH 1M vào A, cũng thu được a gam kết tủa. Giá trị của m là
A. 21.375
B. 42.75
C. 17.1
D. 22.8
Hòa tan a gam Na2O vào 90,7 gam dung dịch NAOH 8% thu được dung dịch NAOH 12% .Tìm giá trị của a
\(m_{NaOH\left(bđ\right)}=\dfrac{90,7.8}{100}=7,256\left(g\right)\)
\(n_{Na_2O}=\dfrac{a}{62}\left(mol\right)\)
PTHH: Na2O + H2O --> 2NaOH
\(\dfrac{a}{62}\)------------->\(\dfrac{a}{31}\)
=> \(m_{NaOH\left(sau.pư\right)}=\dfrac{a}{31}.40+7,256\left(g\right)\)
mdd sau pư = a + 90,7 (g)
=> \(C\%_{dd.sau.pư}=\dfrac{\dfrac{40}{31}a+7,256}{a+90,7}.100\%=12\%\)
=> a = 3,1 (g)
Đúng 3
Bình luận (0)
cho a gam na vào p gam h2o thu được dd naoh x%. cho b gam na2o vào p gam h2o cũng thu được dd naoh x%. lập biểu thức tính p theo a và b
Theo đề bài ta có :
nNa=\(\dfrac{a}{23}mol\)
Ta có PTHH : 1
\(2Na+2H2O\rightarrow2NaOH+H2\)
a/23.........a/23.........a/46
X=\(\dfrac{mct\left(mNaOH\right)}{m\text{dd}NaOH}.100\%=\dfrac{\left(\dfrac{a}{23}\right).40}{a+p-\left(\dfrac{a}{46}\right)}=\dfrac{40a}{23a+23p}\)(1)
Ta có : nNa2O=\(\dfrac{b}{62}mol\)
PTHH 2 :
\(Na2O+H2O\rightarrow2NaOH\: \)
b/62mol................2.(b/62)mol
=> X=\(\dfrac{mct}{m\text{dd}}.100\%=\dfrac{\left(2.\left(\dfrac{b}{62}\right)\right).40}{b+p}=\dfrac{40b}{124b+124p}\left(2\right)\)
Ta cho (1)=(2)
ta có biểu thức :
\(\dfrac{40a}{23a+23p}=\dfrac{40b}{124b+124p}\)
Bạn tự rút gọn biểu thức nhé!
Đúng 0
Bình luận (1)
CHO MÌNH CHỮA LẠI 1 CHÚT nãy ghi nhầm =.=
Theo đề bài ta có :
nNa=\(\dfrac{a}{23}mol\)
PTHH 1 :
\(2Na+2H2O\rightarrow2NaOH+H2\uparrow\)
a/23mol..................2(a/23)mol....1/2(a/23)mol
=> X=\(\dfrac{mct}{m\text{dd}}.100\%=\dfrac{40.2.\left(\dfrac{a}{23}\right)}{a+p-2.\dfrac{1}{2}\left(\dfrac{a}{23}\right)}\)=\(\dfrac{80a}{23a+23p}\)(1)
Theo đề bài ta có :
nNa2O=\(\dfrac{b}{62}mol\)
PTHH 2 :
\(Na2O+H2O\rightarrow2NaOH\)
b/62mol.................2(b/62)mol
=> X= \(\dfrac{mct}{m\text{đ}}.100\%=\dfrac{40.2\left(\dfrac{b}{62}\right)}{b+p}=\dfrac{80b}{62b+62p}\left(2\right)\)
Cho (1)=(2)
Ta có biểu thức : \(\dfrac{80a}{23a+23p}\)= \(\dfrac{80b}{62b+62p}\)
Đúng 0
Bình luận (4)
LÀM TẮT NHA
Dùng điện thoại khó ghi lắm .
Na +2H2O --> 2NaOH + H2 (1)
a/23 mol.................................a/23mol
Na2O + H2O --> 2NaOH(2)
b/62mol...............................b/32mol
mdd(1) = a+p-a/23.x%=40a/22a+23p
mdd(2) = b+ p.x%=40b /31b+31p
=>p=ab/b - 31p
Vậy....
đánh mất 30 phút v:
Đúng 0
Bình luận (1)
hòa tan hoàn toàn m ( gam) Na2O vào 20 gam dung dịch A chứa NaOH 5% và KOH 2% sau khi phản ứng xảy ra hoàn toàn thu được dung dịch B chứa NaOH co nồng độ phần trăm gấp đôi ban đầu ( trong dung dịch A) và KOH . a) tính m ? b) tính nồng độ phần trăm của KOH trong dung dịch B
\(m_{NaOH\left(A\right)}=20.5\%=1\left(g\right)\)
Trong B:
gọi x là khối lượng Na2O thêm vào , x>0 (g)
\(10\%=\dfrac{\dfrac{80}{62}x+1}{x+20}\)
\(\rightarrow x=0,84\left(g\right)\)
Vậy khối Na2O thêm vào dd A là 0,84 (g)
b, \(m_{KOH\left(A\right)}=2\%.20=0,4\left(g\right)\)
\(C\%_{KOH\left(B\right)}=\dfrac{0,4}{20+0,84}.100\%=1,92\%\)
Đúng 3
Bình luận (2)
a. Hòa tan 3,1 gam Na2O vào 50 gam nước. Tính C% của dung dịch thu được? b. Hòa tan hoàn toàn 4,6 gam Na vào 95,6 gam nước. Tính C% của dung dịch thu được ?
Đọc tiếp
a. Hòa tan 3,1 gam Na2O vào 50 gam nước. Tính C% của dung dịch thu được?
b. Hòa tan hoàn toàn 4,6 gam Na vào 95,6 gam nước. Tính C% của dung dịch thu được ?
a, \(Na_2O+H_2O\rightarrow2NaOH\)
Ta có: \(n_{Na_2O}=\dfrac{3,1}{62}=0,05\left(mol\right)\)
Theo PT: \(n_{NaOH}=2n_{Na_2O}=0,1\left(mol\right)\)
m dd sau pư = 3,1 + 50 = 53,1 (g)
\(\Rightarrow C\%_{NaOH}=\dfrac{0,1.40}{53,1}.100\%\approx7,53\%\)
b, \(2Na+2H_2O\rightarrow2NaOH+H_2\)
Ta có: \(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{NaOH}=n_{Na}=0,2\left(mol\right)\\n_{H_2}=\dfrac{1}{2}n_{Na}=0,1\left(mol\right)\end{matrix}\right.\)
Ta có: m dd sau pư = 4,6 + 95,6 - 0,1.2 = 100 (g)
\(\Rightarrow C\%_{NaOH}=\dfrac{0,2.40}{100}.100\%=8\%\)
Đúng 2
Bình luận (0)
Hỗn hợp X gồm Na Ba Na2O BaO. Hòa tan hoàn toàn 21, 9 gam X vào nước, thu được 1,12 lít H2 ở đktc và dung dịch Y, trong đó có 20,52 gam Ba(OH)2 và m gam NaOH. Tính m ?
Gọi số mol NaOH là a (mol)
\(n_{Ba\left(OH\right)_2}=\dfrac{20,52}{171}=0,12\left(mol\right)\); \(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Ta có sơ đồ:
\(21,9\left(g\right)X\left\{{}\begin{matrix}Na\\Ba\\Na_2O\\BaO\end{matrix}\right.+H_2O\rightarrow\left\{{}\begin{matrix}Ba\left(OH\right)_2:0,12\left(mol\right)\\NaOH:a\left(mol\right)\end{matrix}\right.+H_2:0,05\left(mol\right)\)
Bảo toàn H: \(n_{H_2O}=\dfrac{0,12.2+a+0,05.2}{2}=0,17+0,5a\left(mol\right)\)
Bảo toàn khối lượng:
\(m_X+m_{H_2O}=m_{Ba\left(OH\right)_2}+m_{NaOH}+m_{H_2O}\)
=> \(21,9+18\left(0,17+0,5a\right)=20,52+40a+0,05.2\)
=> a = 0,14 (mol)
=> m = 0,14.40 = 5,6 (g)
Đúng 3
Bình luận (0)
Hòa tan 31 gam Na2O vào 400 gam dung dịch NaOH 10% thu đc dung dịch có nồng độ phần trăm là
Na2O=0,5 mol
Na2O+H2O->2NaOH
0,5-----------------1 mol
ta có m NaOH=1.40+40=80g
=>C%=\(\dfrac{80}{431}100=18,561\%\)
Đúng 3
Bình luận (2)
Hòa tan hoàn toàn 5,4 gam hỗn hợp A gồm Na và Na2O vào m gam nước thu được 200 gam dung dịch B. Trung hòa 80 gam dung dịch B bằng axit clohiđric, rồi cô cạn dung dịch tạo thành được 4,68 gam muối khan. Tính m
Dd B chứa NaOH.
PT: \(NaOH+HCl\rightarrow NaCl+H_2O\)
Ta có: \(n_{NaCl}=\dfrac{4,68}{58,5}=0,08\left(mol\right)\)
Theo PT: \(n_{NaOH\left(80\left(g\right)dd\right)}=n_{NaCl}=0,08\left(mol\right)\)
\(\Rightarrow n_{NaOH\left(200\left(g\right)dd\right)}=\dfrac{0,08.200}{80}=0,2\left(mol\right)\)
PT: \(2Na+2H_2O\rightarrow2NaOH+H_2\)
\(Na_2O+H_2O\rightarrow2NaOH\)
Ta có: \(\left\{{}\begin{matrix}23n_{Na}+62n_{Na_2O}=5,4\\n_{Na}+2n_{Na_2O}=0,2\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}n_{Na}=0,1\left(mol\right)\\n_{Na_2O}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H_2}=\dfrac{1}{2}n_{Na}=0,05\left(mol\right)\)
Ta có: m dd B = mA + mH2O - mH2
⇒ 200 = 5,4 + mH2O - 0,05.2
⇒ mH2O = 194,7 (g)
Đúng 2
Bình luận (0)