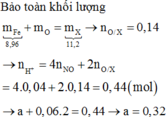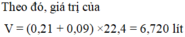Đốt m gam bột sắt trong khí oxi thu được 11,04 gam chất rắn X gồm Fe, Fe3O4, FeO, Fe2O3. Để hòa tan hoàn toàn hỗn hợp cần vừa hết 180 ml dung dịch H2SO4 1M, tạo thành 0,336 lít khí ở đktc. Tính m.
Tuyển Cộng tác viên Hoc24 nhiệm kì 26 tại đây: https://forms.gle/dK3zGK3LHFrgvTkJ6
$n_{H_2SO_4} = 0,18(mol) \Rightarrow n_{H^+} = 0,18.2 = 0,36(mol)$
$n_{H_2} = \dfrac{0,336}{22,4} = 0,015(mol)$
$2H^+ + O^{2-} \to H_2O$
$2H^+ + 2e \to H_2$
Ta có :
$n_{H^+} = 2n_O + 2n_{H_2} \Rightarrow n_O = \dfrac{0,36 - 0,015.2}{2} = 0,165(mol)$
$\Rightarrow m = m_X - m_O = 11,04 - 0,165.16 = 8,4(gam)$
Đúng 3
Bình luận (1)
Nung nóng 8,96 gam bột Fe trong khí O2 một thời gian, thu được 11,2 gam hỗn hợp chất rắn X gồm Fe, FeO, Fe2O3 và Fe3O4. Hòa tan hết X trong dung dịch hỗn hợp gồm a mol HNO3 và 0,06 mol H2SO4, thu được dung dịch Y (không chúa NH4) và 0,896 lít khí NO duy nhất (đktc). Giá trị của a là A. 0,32 B. 0,16 C. 0,04 D. 0,44
Đọc tiếp
Nung nóng 8,96 gam bột Fe trong khí O2 một thời gian, thu được 11,2 gam hỗn hợp chất rắn X gồm Fe, FeO, Fe2O3 và Fe3O4. Hòa tan hết X trong dung dịch hỗn hợp gồm a mol HNO3 và 0,06 mol H2SO4, thu được dung dịch Y (không chúa NH4) và 0,896 lít khí NO duy nhất (đktc). Giá trị của a là
A. 0,32
B. 0,16
C. 0,04
D. 0,44
Nung m gam Fe trong không khí, sau một thời gian ta thu được 34.8 gam hỗn hợp chất rắn X gồm Fe,
Fe
2
O
3
,
Fe
3
O
4
, FeO. Hoà tan hết 34,8 gam hỗn hợp chất rắn X vào dung dịch
HNO
3
dư thu được 3,36 lít khí
NO
2
(đktc) là sản phẩm khử duy nhất....
Đọc tiếp
Nung m gam Fe trong không khí, sau một thời gian ta thu được 34.8 gam hỗn hợp chất rắn X gồm Fe, Fe 2 O 3 , Fe 3 O 4 , FeO. Hoà tan hết 34,8 gam hỗn hợp chất rắn X vào dung dịch HNO 3 dư thu được 3,36 lít khí NO 2 (đktc) là sản phẩm khử duy nhất. Giá trị m là
A. 25,2
B. 12,6
C. 37,8
D. 20,4
Nung m gam Fe trong không khí, sau một thời gian ta thu được 11,2 gam hỗn hợp chất rắn X gồm Fe,
Fe
2
O
3
,
Fe
3
O
4
, FeO. Hoà tan hết 11,2 gam hỗn hợp chất rắn X vào dung dịch
HNO
3
dư thu được 2,24 lít khí
NO
2
(đktc) là sản phẩm khử duy nhất....
Đọc tiếp
Nung m gam Fe trong không khí, sau một thời gian ta thu được 11,2 gam hỗn hợp chất rắn X gồm Fe, Fe 2 O 3 , Fe 3 O 4 , FeO. Hoà tan hết 11,2 gam hỗn hợp chất rắn X vào dung dịch HNO 3 dư thu được 2,24 lít khí NO 2 (đktc) là sản phẩm khử duy nhất. Giá trị m là:
A. 7,28
B. 5,6
C. 8,40
D. 7,40
Đốt nóng một hỗn hợp gồm 5,6 gam bột Fe và 1,6 gam bột S trong môi trường không có không khí, thu được hỗn hợp rắn X. Cho hỗn hợp khí tác dụng hoàn toàn với 500ml dung dịch HCl, thu được hỗn hợp khí A và dung dịch B ( hiệu suất phản ứng đạt 100% )a) Tính thành phần phần trăm theo thể tich của hỗn hợp Ab) Biết rằng cần dùng 125ml dung dịch NaOH 0,1M để trung hòa HCl còn dư trong dung dịch B, hãy tính nồng độ của dung dịch HCl đã dùng
Đọc tiếp
Đốt nóng một hỗn hợp gồm 5,6 gam bột Fe và 1,6 gam bột S trong môi trường không có không khí, thu được hỗn hợp rắn X. Cho hỗn hợp khí tác dụng hoàn toàn với 500ml dung dịch HCl, thu được hỗn hợp khí A và dung dịch B ( hiệu suất phản ứng đạt 100% )
a) Tính thành phần phần trăm theo thể tich của hỗn hợp A
b) Biết rằng cần dùng 125ml dung dịch NaOH 0,1M để trung hòa HCl còn dư trong dung dịch B, hãy tính nồng độ của dung dịch HCl đã dùng
`a)`
`n_{Fe}=0,1(mol);n_S=0,05(mol)`
`S+Fe` $\xrightarrow{t^o}$ `FeS`
`0,05->0,05->0,05(mol)`
`0,1>0,05->Fe` dư.
`->X` gồm `Fe:0,1-0,05=0,05(mol);FeS:0,05(mol)`
`Fe+2HCl->FeCl_2+H_2`
`FeS+2HCl->FeCl_2+H_2S`
Theo PT: `n_{H_2}=n_{Fe}=0,05(mol);n_{H_2S}=n_{FeS}=0,05(mol)`
`->\%V_{H_2}=\%V_{H_2S}={0,05}/{0,05+0,05}.100\%=50\%`
`b)`
`n_{NaOH}=0,125.0,1=0,0125(mol)`
`NaOH+HCl->NaCl+H_2O`
Theo PT: `\sum n_{HCl}=n_{NaOH}+2n_{H_2}+2n_{H_2S}=0,2125(mol)`
`->C_{M\ HCl}={0,2125}/{0,5}=0,425M`
Đúng 2
Bình luận (0)
Đốt cháy 16,8 gam bột Fe trong V lít (đktc) hỗn hợp khí gồm Cl2 và O2, thu được hỗn hợp chất rắn X gồm các oxit và muối (không thấy khí thoát ra). Hòa tan X trong 480 ml dung dịch HCl 1M, thu được dung dịch Y. Cho dung dịch AgNO3 dư vào Y, thấy thoát ra 0,03 mol khí NO (sản phẩm khử duy nhất của
N
+
5
), đồng thời thu được 132,39 gam kết tủa. Giá trị của V là A. 6,272 B. 7,168 C. 6,720 D. 5,600
Đọc tiếp
Đốt cháy 16,8 gam bột Fe trong V lít (đktc) hỗn hợp khí gồm Cl2 và O2, thu được hỗn hợp chất rắn X gồm các oxit và muối (không thấy khí thoát ra). Hòa tan X trong 480 ml dung dịch HCl 1M, thu được dung dịch Y. Cho dung dịch AgNO3 dư vào Y, thấy thoát ra 0,03 mol khí NO (sản phẩm khử duy nhất của N + 5 ), đồng thời thu được 132,39 gam kết tủa. Giá trị của V là
A. 6,272
B. 7,168
C. 6,720
D. 5,600
Đốt cháy 16,8 gam bột Fe trong V lít (đktc) hỗn hợp khí gồm Cl2 và O2, thu được hỗn hợp chất rắn X gồm các oxit và muối (không thấy khí thoát ra). Hòa tan X trong 480 ml dung dịch HCl 1M, thu được dung dịch Y. Cho dung dịch AgNO3 dư vào Y, thấy thoát ra 0,03 mol khí NO (sản phẩm khử duy nhất của
N
+
5
), đồng thời thu được 132,39 gam kết tủa. Giá trị của V là A. 6,272 B. 7,168 C. 6,...
Đọc tiếp
Đốt cháy 16,8 gam bột Fe trong V lít (đktc) hỗn hợp khí gồm Cl2 và O2, thu được hỗn hợp chất rắn X gồm các oxit và muối (không thấy khí thoát ra). Hòa tan X trong 480 ml dung dịch HCl 1M, thu được dung dịch Y. Cho dung dịch AgNO3 dư vào Y, thấy thoát ra 0,03 mol khí NO (sản phẩm khử duy nhất của N + 5 ), đồng thời thu được 132,39 gam kết tủa. Giá trị của V là
A. 6,272
B. 7,168
C. 6,720
D. 5,600
Đáp án C
Sơ đồ quá trình:
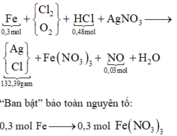
Bảo toàn nguyên tố N có 0,93 mol AgNO3 → 132,39 gam kết tủa gồm 0,93 mol Ag + 0,9 mol Cl
→ Theo bảo toàn nguyên tố Cl ta có n Cl 2 = 0,21 mol
Tiếp tục, bảo toàn H có 0,24 mol H2O sau đó bảo toàn nguyên tố O ta có n O 2 =0,09 mol
Theo đó, giá trị của V = (0,21 + 0,09) ×22,4 = 6,720 lít
Đúng 0
Bình luận (0)
Để m gam bột Fe ra ngoài không khí thu được 12,8 gam hỗn hỗn gồm 4 chất rắn (FeO; Fe2O3; Fe3O4 và Fe dư). Hoà tan hoàn hoàn toàn 4 chất rắn này trong dung dịch HNO3 lấy dư 10% thấy thoát ra một khí không màu, hoá nâu trong không khí có thể tích 2,24 lit (ở đktc). Tính m.
Cho m gam hỗn hợp gồm Al, Cu tác dụng với dd H2SO4 loãng dư, thu được 13, 44 lít khí (đktc) và chất rắn không tan. Đem đốt cháy chất rắn không tan thu được 24 gam chất bột màu đen.
a. Tính m.
b. Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu111
Đọc tiếp
Cho m gam hỗn hợp gồm Al, Cu tác dụng với dd H2SO4 loãng dư, thu được 13, 44 lít khí (đktc) và chất rắn không tan. Đem đốt cháy chất rắn không tan thu được 24 gam chất bột màu đen.
a. Tính m.
b. Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu111
Đốt cháy 20 gam bột sắt trong bình chứa V lít khí O2 đo ở đktc thu được 26,4 gam hỗn hợp chất rắn X gồm Fe và Fe3O4. Biết các phản ứng xảy ra hoàn toàn.
a. Tính giá trị của V?
b. Tính phần trăm khối lượng Fe3O4 trong hỗn hợp X?
c. Tính khối lượng KClO3 hoặc KMnO4 cần dùng để điều chế ra lượng oxi cho phản ứng học trên?
a)
Theo ĐLBTKL: \(m_{Fe\left(bđ\right)}+m_{O_2}=m_X\)
=> \(m_{O_2}=26,4-20=6,4\left(g\right)\)
=> \(n_{O_2}=\dfrac{6,4}{32}=0,2\left(mol\right)\Rightarrow V=0,2.22,4=4,48\left(l\right)\)
b)
PTHH: 3Fe + 2O2 --to--> Fe3O4
0,2------->0,1
=> \(\%m_{Fe_3O_4}=\dfrac{0,1.232}{26,4}.100\%=87,88\%\)
c)
- Nếu dùng KClO3
PTHH: 2KClO3 --to--> 2KCl + 3O2
\(\dfrac{0,4}{3}\)<-----------------0,2
=> \(m_{KClO_3}=\dfrac{0,4}{3}.122,5=\dfrac{49}{3}\left(g\right)\)
- Nếu dùng KMnO4:
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,4<--------------------------------0,2
=> \(m_{KMnO_4}=0,4.158=63,2\left(g\right)\)
Đúng 6
Bình luận (0)