Đốt cháy sắt trong khí clo dư thu được muối là
A. Fe3O4
B. FeCl2
C. FeCl3
D. FeCl2, FeCl3
Đốt cháy sắt trong khí clo, người ta thu được 32,5 gam muối F e C l 3 . Thể tích khí clo (đktc) đã tham gia phản ứng là
A. 6,72 lít.
B. 13,44 lít.
C. 4,48 lít.
D. 2,24 lít.
Chọn đáp án A
n F e C l 3 = 32 , 5 162 , 5 = 0 , 2 m o l
Bảo toàn nguyên tố Cl
2 n C l 2 = 3 n F e C l 3 ⇒ n C l 2 = 0 , 3 m o l ⇒ V = 0 , 3.22 , 4 = 6 , 72 l
Cho 12,7 gam muối sắt clorua vào dung dịch NaOH có dư trong bình kín, thu được 9 gam một chất kết tủa. Công thức hoá học của muối là
A. FeCl 3 ; B. FeCl 2 ; C. FeCl; D. FeCl 4
Đáp án B.
Gọi công thức của muối là FeCl x (x là hóa trị của kim loại Fe).
Phương trình hóa học:
FeCl x + xNaOH → Fe OH x + xNaCl
(56+35,5x)gam (56+17x)gam
12,7 gam 9 gam
Ta có tỷ lệ:
(56+35,5x)/12,7 = (56+17x)/9 => x = 2 → Công thức của muối là FeCl 2
Hỗn hợp X gồm FeO, Fe2O3 và Fe3O4 có khối lượng là 38,4 gam. Hòa tan X trong dung dịch HCl dư thu được dung dịch Y chứa 25,4 gam muối FeCl2. Khối lượng muối FeCl3 trong dung dịch Y là:
A. 24,375 g.
B. 48,75 g.
C. 32,5 g.
D. 16,25 g
Các phản ứng xảy ra khi cho hỗn hợp X vào dung dịch HCl:

Sản phẩm muối tạo thành chỉ gồm FeCl2 và FeCl3
Quy đổi hỗn hợp X ban đầu thành hỗn hợp gồm FeO và Fe2O3.
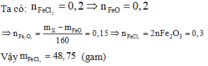
Đáp án B
Thực hiện các thí nghiệm sau:
(a) Cho bột Mg dư vào dung dịch FeCl3.
(b) Đốt cháy Fe trong khí Cl2 dư.
(c) Cho bột Fe3O4 vào dung dịch H2SO4 đặc, nóng, dư.
(d) Cho bột Fe vào dung dịch AgNO3 dư.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được muối Fe(II) là
A. 2.
B. 3.
C. 4.
D. 0.
Đáp án D
(a) Mg + 2FeCl3 → MgCl2 + 2FeCl2.
Sau đó, do Mg dư nên sau đó: Mg + FeCl2 → MgCl2 + Fe.
(b) 2Fe + 3Cl2 → 2FeCl3.
(c) 2Fe3O4 + 10H2SO4đặc, dư → 3Fe2(SO4)3 + SO2 + 10H2O.
(d) Fe + 2AgNO3 → Fe(NO3)2 + 2Ag.
Do AgNO3 dư nên sau đó: Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag.
Vậy không có thí nghiệm nào thu được muối Fe(II) sau khi các phản ứng xảy ra hoàn toàn.
Thực hiện các thí nghiệm sau:
(a) Cho bột Mg dư vào dung dịch FeCl3.
(b) Đốt cháy Fe trong khí Cl2 dư.
(c) Cho bột Fe3O4 vào dung dịch H2SO4 đặc, nóng, dư.
(d) Cho bột Fe vào dung dịch AgNO3 dư.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được muối Fe(II) là
A. 2.
B. 3.
C. 4.
D. 0
Đáp án D
(a) Mg + 2FeCl3 → MgCl2 + 2FeCl2.
Sau đó, do Mg dư nên sau đó: Mg + FeCl2 → MgCl2 + Fe.
(b) 2Fe + 3Cl2 → 2FeCl3.
(c) 2Fe3O4 + 10H2SO4đặc, dư → 3Fe2(SO4)3 + SO2 + 10H2O.
(d) Fe + 2AgNO3 → Fe(NO3)2 + 2Ag.
Do AgNO3 dư nên sau đó: Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag.
Vậy không có thí nghiệm nào thu được muối Fe(II) sau khi các phản ứng xảy ra hoàn toàn.
Cho 3,25 gam sắt clorua (chưa biết hóa trị) tác dụng với dung dịch AgNO3 dư, thu được 8,61 gam kết tủa. Công thức của muối sắt clorua nào sau đây là đúng?
A. FeCl2
B. FeCl3
C. FeCl4
D. FeCl
Đặt hóa trị Fe là x(x>0)
\(FeCl_x+xAgNO_3\to xAgCl\downarrow+Fe(NO_3)_x\\ \Rightarrow n_{FeCl_x}=\dfrac{n_{AgCl}}{x}=\dfrac{\dfrac{8,61}{143,5}}{x}=\dfrac{0,06}{x}\\ \Rightarrow M_{FeCl_x}=\dfrac{3,25}{\dfrac{0,06}{x}}=\dfrac{325}{6}x\\ \Rightarrow 56+35,5x=\dfrac{325}{6}x\\ \Rightarrow 56=\dfrac{56}{3}x\\ \Rightarrow x=3\\ \Rightarrow CTHH:FeCl_3\)
hòa tan hoàn toàn 11,2 g hỗn hợp Fe, FeO, F2O3 Fe3O4 vào dung dịch Hcl dư thu được 12,7 g muối Fecl2. tính số gam Fecl3
fe+2hcl=>fecl2+h2
feo+2hcl=>fecl2+h2o
fe2o3+6hcl=>2fecl3+3h2o
fe3o4+8hcl=>fecl2+2fecl3+4h2o
- n fecl2 = 12,7/127=0,1 mol
công nhận bài khó làm đấy -__- hỗn hợp có 3 ẩn khó chơi v~
Bạn quy đổi hỗn hợp thành \(\begin{cases}FeO:xmol\\Fe_2O_3:ymol\end{cases}\)
ta có : 72x + 160y = 11,2
FeO \(\rightarrow\)FeCl2
x x => x= 0,1
=> y = 0,025
Fe2O3 \(\rightarrow\)2FeCl3
0,025 2. 0,025
=> mFeCl3 = 8,125 gam
Câu 1: Nhôm có tính chất hóa học riêng là có thể tác dụng được với:
A. HCl B. H2SO4 C. HNO3 D. NaOH
Câu 2: Sắt tác dụng với khí clo ở nhiệt độ cao sinh ra hợp chất:
A. FeCl3 B. FeCl2 C. FeCl D. Fe3Cl
Câu 3: Nhôm và sắt đều tác dụng được với dung dịch của:
A. NaOH B. KOH C. HCl D. Ba(OH)2
Câu 4: Sắt cháy trong khí oxi sinh ra:
A. Fe3O4 B. FeO C. Fe2O3 D. Fe2O
Câu 5: Nhôm tác dụng với axit clohiđric sinh ra muối:
A. AlCl2 B. AlCl C. AlCl3 D. Al2Cl3
Câu 6: Nguyên tắc trong sản xuất gang là dùng chất khử nào để khử quặng sắt?
A. H2 B. CO C. CO2 D. NO
Câu 7: Nguyên tắc trong sản xuất thép là dùng chất oxihóa nào để loại bỏ bớt các nguyên tố C, Mn, Si... trong gang?
A. Khí oxi B. Khí nitơ C. Khí oxi và gỉ sắt D. Khí CO
Câu 8: Hòa tan 2,7 gam Al cần dùng V lít dung dịch axit sunfuric H2SO4 1M. Giá trị của V là:
A. 0,15 B. 0,2 C. 0,25 D. 0,3
Câu 9: Để khủ hoàn toàn a gam Fe2O3 cần dùng 6,72 lít khí CO ở đktc. Giá trị của a là:
A. 16 B. 8 C. 24 D. 32
Câu 10: Hòa tan hoàn toàn 8 gam hỗn hợp A gồm 30% Mg và 70% Fe bằng dung dịch HCl dư, sau phản ứng thu được V lít khí H2 ở đktc. Giá trị của V là:
A. 2,24 B. 3,36 C. 4,48 D. 6,72
Câu 1: Nhôm có tính chất hóa học riêng là có thể tác dụng được với:
A. HCl B. H2SO4 C. HNO3 D. NaOH
Câu 2: Sắt tác dụng với khí clo ở nhiệt độ cao sinh ra hợp chất:
A. FeCl3 B. FeCl2 C. FeCl D. Fe3Cl
Câu 3: Nhôm và sắt đều tác dụng được với dung dịch của:
A. NaOH B. KOH C. HCl D. Ba(OH)2
Câu 4: Sắt cháy trong khí oxi sinh ra:
A. Fe3O4 B. FeO C. Fe2O3 D. Fe2O
Câu 5: Nhôm tác dụng với axit clohiđric sinh ra muối:
A. AlCl2 B. AlCl C. AlCl3 D. Al2Cl3
Câu 6: Nguyên tắc trong sản xuất gang là dùng chất khử nào để khử quặng sắt?
A. H2 B. CO C. CO2 D. NO
Câu 7: Nguyên tắc trong sản xuất thép là dùng chất oxihóa nào để loại bỏ bớt các nguyên tố C, Mn, Si... trong gang?
A. Khí oxi B. Khí nitơ C. Khí oxi và gỉ sắt D. Khí CO
Câu 8: Hòa tan 2,7 gam Al cần dùng V lít dung dịch axit sunfuric H2SO4 1M. Giá trị của V là:
A. 0,15 B. 0,2 C. 0,25 D. 0,3
Câu 9: Để khủ hoàn toàn a gam Fe2O3 cần dùng 6,72 lít khí CO ở đktc. Giá trị của a là:
A. 16 B. 8 C. 24 D. 32
Câu 10: Hòa tan hoàn toàn 8 gam hỗn hợp A gồm 30% Mg và 70% Fe bằng dung dịch HCl dư, sau phản ứng thu được V lít khí H2 ở đktc. Giá trị của V là:
A. 2,24 B. 3,36 C. 4,48 D. 6,72
Cho 11,2 g sắt tác dụng vừa đủ với khí clo (Cl2)sau phản ứng thu được muối sắt (III) clorua (FeCl3) A. Tính thể tích khí clo cần dùng . B. Tính khối lượng muối sắt (III) clorua (FeCl3) biết Cl = 35,5 .Fe = 56.
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\ 2Fe+3Cl_2\rightarrow\left(t^o\right)2FeCl_3\\ n_{Cl_2}=\dfrac{3}{2}.0,2=0,3\left(mol\right)\\ n_{FeCl_3}=n_{Fe}=0,2\left(mol\right)\\ a,V_{Cl_2\left(đktc\right)}=0,3.22,4=6,72\left(l\right)\\ b,m_{FeCl_3}=162,5.0,2=32,5\left(g\right)\)
a, \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PT: \(2Fe+3Cl_2\underrightarrow{t^o}2FeCl_3\)
Theo PT: \(n_{Cl_2}=\dfrac{3}{2}n_{Fe}=0,3\left(mol\right)\)
\(\Rightarrow V_{Cl_2}=0,3.22,4=6,72\left(l\right)\)
b, \(n_{FeCl_3}=n_{Fe}=0,2\left(mol\right)\Rightarrow m_{FeCl_3}=0,2.162,5=32,5\left(g\right)\)