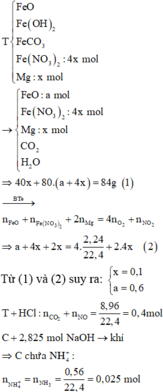Để tác dụng vừa đủ với 44,8 gam hỗn hợp gồm FeO, Fe 2 O 3 , Fe 3 O 4 cần phải dùng 400 ml dung dịch H 2 SO 4 2M. Sau phản ứng thấy tạo ra a gam hỗn hợp muối sunfat. Hãy tính a.
NN
Những câu hỏi liên quan
Để tác dụng vừa đủ với 44,8 gam hỗn hợp gồm FeO , Fe2O3 , Fe3O4 cần phải dùng 400ml dd axit sunfuric 2M ( loãng ) sau phản ưng thu được m gam hỗn hộp muối sunfat . Tính m
\(n_{H_2SO_4}=2.0,4=0,8\left(mol\right)\)
PTHH: \(FeO+H_2SO_4\rightarrow FeSO_4+H_2O\left(1\right)\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\left(2\right)\)
\(Fe_3O_4+4H_2SO_4\rightarrow Fe\left(SO_4\right)_3+FeSO_4+4H_2O\left(3\right)\)
Theo (3) ta có: \(n_{H_2O}=n_{H_2SO_4}=0,8\left(mol\right)\)
Theo định luật bảo toàn kl:
\(m_{hh}+m_{H_2SO_4}=m_{muốisunfat}+m_{H_2O}\)
\(\Rightarrow m_{muôisunfat}=m_{hh}+m_{H_2SO_4}-m_{H_2O}=44,8+0,8.98-0,8.18=108,8\left(g\right)\)
Đúng 1
Bình luận (0)
Chia 64,42 gam hỗn hợp gồm FeO, Fe 3 O 4 , CuO, ZnO, Fe 2 O 3 thành hai phần bằng nhau.
Phần 1 tác dụng hết với axit HCl thu được 59,16 gam muối khan.
Phần 2 tác dụng vừa đủ với 1 lít dung dịch A chứa hỗn hợp HCl và H 2 SO 4 loãng thu được
65,41 gam muối khan.
Tính nồng độ mỗi axit trong dung dịch A.
Giả sử trong mỗi phần có: \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\\n_{Zn}=c\left(mol\right)\\n_O=d\left(mol\right)\end{matrix}\right.\)
=> 56a + 64b + 65c + 16d = 32,21
P1:
nO = nH2O = d (mol)
=> nHCl = 2d (mol)
Theo ĐLBTKL: mrắn bđ + mHCl = mmuối + mH2O
=> 32,21 + 73d = 59,16 + 18d
=> d = 0,49 (mol)
P2:
Gọi số mol HCl, H2SO4 là a, b (mol)
nH2O = nO = 0,49 (mol)
Bảo toàn H: a + 2b = 0,98 (1)
Theo ĐLBTKL: mrắn bđ + mHCl + mH2SO4 = mmuối + mH2O
=> 32,21 + 36,5a + 98b = 65,41 + 0,49.18
=> 36,5a + 98b = 42,02 (2)
(1)(2) => a = 0,48 (mol); b = 0,25 (mol)
=> \(\left\{{}\begin{matrix}C_{M\left(HCl\right)}=\dfrac{0,48}{1}=0,48M\\C_{M\left(H_2SO_4\right)}=\dfrac{0,25}{1}=0,25M\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Để tác dụng vừa đủ với 44,8 g hỗn hợp gồm FeO, Fe2O3 , FeO cần dùng 400 ml dung dịch H2SO4.Nồng độ là 2 M, sau phản ứng thấy tạo ra a (g) hỗn hợp muối sunfat. Tìm a
hỗn hợp gồm FeO, Fe2O3 và Fe3O4 nhé các bạn
Đúng 0
Bình luận (0)
em đang cần gấp ạ Để tác dụng vừa đủ với 17,92 gam hỗn hợp gồm FeO, FejO4, Fe,O, cần phải dùng 160 ml dung dịch H,SO4 2M. Sau phản ứng thấy tạo ra m gam hỗn hợp muối sunfat. Tính m.
1. Để tác dụng hết 2,32 gam hỗn hợp gồm FeO, Fe2O3, Fe3O4 cần dùng vừa đủ 80ml dung dịch HCl 1M. Nếu khử 2,32 gam hỗn hợp trên bằng CO thì thu được bao nhiêu gam Fe.
2. Hoà tan hết m gam kim loại gồm Mg; Zn; Al và Fe vào dung dịch HCl 0,5M vừa đủ thu được 4,48lít H2 đktc.Tìm thể tích dung dịch HCl đã dùng
Bài 1:
Ta có: \(n_{HCl}=0,08.1=0,08\left(mol\right)\)
BTNT H và O, có: \(n_{H_2O}=\dfrac{1}{2}n_{HCl}=0,04\left(mol\right)\)
⇒ nO (trong oxit) = nH2O = 0,04 (mol)
Có: mhh = mFe + mO
⇒ mFe = 2,32 - 0,04.16 = 1,68 (g)
Bài 2:
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
BTNT H, có: \(n_{HCl}=2n_{H_2}=0,4\left(mol\right)\)
\(\Rightarrow V_{ddHCl}=\dfrac{0,4}{0,5}=0,8\left(l\right)\)
Bạn tham khảo nhé!
Đúng 3
Bình luận (0)
5.6 để tác dụng vừa đủ với 44,8 gam hỗn hợp gồm feo , fe2o3 , fe3o4 cần phải dùng 400ml dung dịch h2so4 2M sau phản ứng thấy tạo ra a gam hỗn hợp muối sunfat . Hãy tính a
Theo đề bài ta có : nH2SO4 = 2.0,4=0,8 (mol)
Ta có PTHH :
\(\left(1\right)FeO+H2SO4->FeSO4+H2O\)
\(\left(2\right)Fe2O3+H2SO4->Fe2\left(SO4\right)3+H2O\)
\(\left(3\right)Fe3O4+4H2SO4->FeSO4+Fe2\left(SO4\right)3+4H2O\)
Gọi chung hh oxit sắt là X
Ta có PTHH TQ :\(X+H2SO4->mu\text{ối}-s\text{unf}at+H2O\)
Theo 3 PTHH ta có : nH2O = nH2SO4 = 0,8 (mol)
Áp dụng ĐLBTKL ta có :
\(mX+mH2SO4=m_{mu\text{ối}-s\text{unf}at}+mH2O\)
=> m\(_{mu\text{ối}-s\text{unf}at}=mX+mH2SO4-mH2O=44,8+0,8.98-0,8.18=108,8\left(g\right)\)
Vậy.........
Đúng 0
Bình luận (1)
Nung m gam hỗn hợp T gồm FeO, Fe(OH)2, FeCO3, Fe(NO3)2 (4x mol) và Mg (x mol) trong bình kín có chứa 2,24 lít khí O2. Sau khi phản ứng xảy ra hoàn toàn, thu được 84 gam hỗn hợp rắn X gồm MgO, Fe2O3 và hỗn hợp Y gồm 3 khí và hơi. Cho m gam T tác dụng với dung dịch HCl vừa đủ, thu được dung dịch C và 8,96 lít hỗn hợp khí gồm NO và CO2. Cho C tác dụng vừa đủ với dung dịch chứa 2,825 mol NaOH, thu được 0,56 lít khí duy nhất. Phần trăm số mol của FeCO3 trong T là A. 17,17%. B. 18,18%. C. 19,19%. D...
Đọc tiếp
Nung m gam hỗn hợp T gồm FeO, Fe(OH)2, FeCO3, Fe(NO3)2 (4x mol) và Mg (x mol) trong bình kín có chứa 2,24 lít khí O2. Sau khi phản ứng xảy ra hoàn toàn, thu được 84 gam hỗn hợp rắn X gồm MgO, Fe2O3 và hỗn hợp Y gồm 3 khí và hơi. Cho m gam T tác dụng với dung dịch HCl vừa đủ, thu được dung dịch C và 8,96 lít hỗn hợp khí gồm NO và CO2. Cho C tác dụng vừa đủ với dung dịch chứa 2,825 mol NaOH, thu được 0,56 lít khí duy nhất. Phần trăm số mol của FeCO3 trong T là
A. 17,17%.
B. 18,18%.
C. 19,19%.
D. 20,20%.
Cho m gam Fe3O4 , tác dụng với H2 đun nóng , thu được hỗn hợp rắn X gồm Fe và FeO. X tác dụng vừa đủ với 600 ml dung dịch H2SO4 1M . Tính giá trị của m .
\(n_{H_2SO_4}=0.6\left(mol\right)\)
\(4Fe^{\dfrac{+3}{4}}\rightarrow4Fe^{3+}+9e\)
\(x...................\dfrac{9}{4}x\)
\(S^{+6}+2e\rightarrow S^{+4}\)
\(0.6......1.2\)
Bảo toàn e :
\(\dfrac{9}{4}x=1.2\Rightarrow x=\dfrac{8}{15}\)
\(m=\dfrac{8}{15}\cdot232=123.7\left(g\right)\)
Đúng 3
Bình luận (0)
Cho dung dịch HCl 0,5M tác dụng vừa đủ với 21,6 gam hỗn hợp A gồm Fe, FeO,
FeCO
3
. Thấy thoát ra một hỗn hợp khí có tỉ khối đối với
H
2
là 15 và tạo ra 31,75 gam muối clorua. Tính % khối lượng của mỗi chất trong hỗn hợp A.
Đọc tiếp
Cho dung dịch HCl 0,5M tác dụng vừa đủ với 21,6 gam hỗn hợp A gồm Fe, FeO, FeCO 3 . Thấy thoát ra một hỗn hợp khí có tỉ khối đối với H 2 là 15 và tạo ra 31,75 gam muối clorua. Tính % khối lượng của mỗi chất trong hỗn hợp A.
Phương trình hóa học :
Fe + 2HCl → FeCl 2 + H 2
FeO + 2HCl → FeCl 2 + H 2 O
FeCO 3 + 2HCl → FeCl 2 + H 2 O + CO 2
Tính % khối lượng: Gọi số mol Fe, FeO, FeCO 3 trong hỗn hợp là x, y, z => x + y + z = 0,25
Theo phương trình hóa học : Số mol H 2 , CO 2 là x, z
![]()
Mặt khác : 56x + 72y + 116z = 21,6
Giải ra ta có:
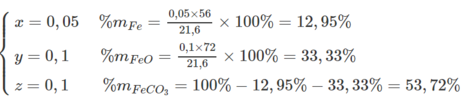
Đúng 0
Bình luận (1)