Tính khối lượng của Kali hidroxit có trong 50ml dung dịch kali hidroxit 2M
BC
Những câu hỏi liên quan
Cho 224,0 ml CO2 (đktc) hấp thụ hết trong 100 ml dung dịch kali hidroxit 0,2M. Tính khối lượng của những chất có trong dung dịch tạo thành.
$n_{KOH} = 0,1.0,2 = 0,02(mol) ; n_{CO_2} = \dfrac{224}{1000.22,4} = 0,01(mol)$
Ta thấy : $n_{KOH} : n_{CO_2} = 0,02 : 0,01 = 2$ nên tạo thành muối trung hòa
$2KOH + CO_2 \to K_2CO_3 + H_2O$
$n_{K_2CO_3} = n_{CO_2} = 0,01(mol)$
$m_{K_2CO_3} = 0,01.138 = 1,38(gam)$
Đúng 3
Bình luận (0)
Cho 224,0 ml CO2 (đktc) hấp thụ hết trong 100,0ml dung dịch kali hidroxit 0,200 M. Tính khối lượng của những chất có trong dung dịch tạo thành

Ta có tỉ lệ:
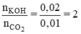
⇒ Phương trình tạo muối trung hoà
CO2 + 2KOH → K2CO3 + H2O
⇒ Dung dịch sau phản ứng có
mK2CO3 = 0,01.138 = 1,38 g
Đúng 0
Bình luận (0)
Cho 224,0 ml CO2 (dktc) hấp thụ hết trong 100,0ml dung dịch kali hidroxit 0,200 M. Tính khối lượng của những chất có trong dung dịch tạo thành.
nCO2 = 0,224:22,4 = 0,01 (mol);
nKOH = 0,1 x 0,2 = 0,02 (mol)
2 KOH + CO2 → K2CO3 + H2O
\(\frac{n_{KOH}}{n_{CO2}}=\frac{0,02}{0,01}=2\)
Trong dung dịch sau phản ứng chỉ có K2CO3:
mK2CO3 = 0,01. 138 = 1,38 (g)
BÀI NÀY DỄ MÀ
Đúng 0
Bình luận (0)
=
= 0,0100 (mol); nKOH = 1,00 x 0,200 = 0,0200 (mol)
2 KOH + CO2 → K2CO3 + H2O
=
= 2
Trong dung dịch sau phản ứng chỉ có K2CO3: = 0,01. 138 = 1,38 (g)
Đúng 0
Bình luận (0)
cho 224,0 lít khí CO2 (điều kienj tiêu chuẩn) hấp thụ hết trong 100ml dung dịch kali hidroxit 0,2M . tính khối lượng của những chất có trong dụng dịch tạo thành .
số mol CO2 = 0.224/22.4 = 0.01 mol
số mol KOH = 0.1*0.2 = 0.02 mol
ptpu
CO2 + 2 KOH = K2CO3
0.01 mol 0.02 mol 0.01 mol
các chất đều tham gia pư hết ngaylanb đầu ko còn chất nào dư
vậy dd tạo thành chỉ có K2CO3
m = 0.01* ( 39*2 + 12 + 16*3 ) = 0.01*138 = 1.38 gam
Chúc bạn học tốt ^^
Đúng 0
Bình luận (0)
Câu 6: Cho 31,2 gam kali vào nước dư, thu được V lít khí đktc.
a. Tính V.
b. Tính khối lượng kali hidroxit tạo thành.
c. Tính nồng độ phần trăm của dung dịch thu được. Biết khối lượng nước ban đầu là 200 gam.......giúp với mn ơi :((
\(n_K=\dfrac{31,2}{39}=0,8\left(mol\right)\)
PTHH :
\(2K+2H_2O\underrightarrow{t^o}2KOH+H_2\uparrow\)
0,8 0,8 0,4
\(a,V_{H_2}=0,4.22,4=8,96\left(l\right)\)
\(b,m_{KOH}=0,8.56=44,8\left(g\right)\)
\(m_{ddKOH}=\left(31,2+200\right)-\left(0,4.2\right)=300,4\left(g\right)\)
\(c,C\%_{KOH}=\dfrac{44,8}{\left(200+31,2\right)-\left(0,4.2\right)}.100\%\approx19,44\%\)
Đúng 2
Bình luận (0)
Cho 100 gam dung dịch kali hidroxit 14% tác dụng hết với dung dịch đồng (II) clorua 25%.
a. Tính khối lượng dung dịch đồng (II) clorua đã tham gia phản ứng.
b. Tính khối lượng kết tủa thu được sau phản ứng.
c. Tính nồng độ phần trăm của chất trong dung dịch thu được sau phản ứng.
d. Nung kết tủa Cu(OH)2 thu được trong không khí đến khối lượng không đổi. Tính khối lượng chất rắn thu được sau khi nung.
Đọc tiếp
Cho 100 gam dung dịch kali hidroxit 14% tác dụng hết với dung dịch đồng (II) clorua 25%. a. Tính khối lượng dung dịch đồng (II) clorua đã tham gia phản ứng. b. Tính khối lượng kết tủa thu được sau phản ứng. c. Tính nồng độ phần trăm của chất trong dung dịch thu được sau phản ứng. d. Nung kết tủa Cu(OH)2 thu được trong không khí đến khối lượng không đổi. Tính khối lượng chất rắn thu được sau khi nung.
\(n_{KOH}=\dfrac{100.14}{100.56}=0,25(mol)\\ 2KOH+CuCl_2\to Cu(OH)_2\downarrow+2KCl\\ \Rightarrow n_{CuCl_2}=n_{Cu(OH)_2}=0,125(mol);n_{KCl}=0,25(mol)\\ a,m_{CuCl_2}=0,125.135=16,875(g)\\ b,m_{Cu(OH)_2}=0,125.98=12,25(g)\\ c,C\%_{KCl}=\dfrac{0,25.74,5}{100+16,875-12,25}.100\%=17,8\%\\ d,Cu(OH)_2\xrightarrow{t^o}CuO+H_2O\\ \Rightarrow n_{CuO}=0,125(mol)\\ \Rightarrow m_{CuO}=0,125.80=10(g)\)
Đúng 2
Bình luận (3)
cho 50ml axit sunfuric 1M tác dụng với 60ml natri hidroxit aM. dung dịch sau phản ứng làm quỳ chuyển đỏ. để dung dịch không làm đổi màu quỳ, người ta cho thêm dung dịch trên 20ml kali hidroxit 0,5M. tìm a
\(n_{H_2SO_4}=0,05mol\)
\(n_{NaOH}=0,06amol\)
\(n_{KOH}=0,02.0,5=0,01mol\)
2NaOH+H2SO4\(\rightarrow\)Na2SO4+2H2O
0,06a\(\rightarrow\)0,03a
H2SO4+2KOH\(\rightarrow\)K2SO4+2H2O
0,005\(\leftarrow\)0,01
-Ta có: 0,03a+0,005=0,05\(\rightarrow\)0,03a=0,045\(\rightarrow\)a=1,5M
Đúng 0
Bình luận (0)
a) Hòa tan 7,5 gam kali hidroxit(KOH) vào 42,5 gam nước(H2O).Hãy tính nồng độ phần trăm của dung dịch b)Trong 16ml dung dịch có hòa tan1,26 gam axit nitric(HNO3).Hãy tính nồng độ mol của dung dịch.
a)
\(C\%_{dd.KOH}=\dfrac{7,5}{7,5+42,5}.100\%=15\%\)
b) \(n_{HNO_3}=\dfrac{1,26}{63}=0,02\left(mol\right)\Rightarrow C_{M\left(dd.HNO_3\right)}=\dfrac{0,02}{0,016}=1,25M\)
Đúng 1
Bình luận (0)
Bài 1: Trung hoà 500ml dung dịch axit clohidric 0,5M bằng 200 ml dung dịch Kali hidroxit aM thu được dd muối kali clorua
A) tính a
b) tính nồng độ mol đd muối kali clorua






