a,viết cấu hình electron của các cặp nguyên tử có số hiệu nguyên tử là 11;12;7;15;26;10;18
b, nhận xét số electron lớp ngoài cung của từng cặp
c, những cặp nào là kim loại , phi kim , khí hiếm ?
Câu 2. Hai nguyên tố A và B ở hai phân nhóm chính liên tiếp trong bảng tuần hoàn các nguyên tố hốa học. Tống số hiệu nguyên tử của A và B là 31. Xác định số hiệu nguyên tử, viết cấu hình electron của các nguyên tử của A và B. Viết cấu hình electron của các ion tạo thành
Giả sử \(Z_A< Z_B\)
Theo bài ra, ta có: \(Z_A+Z_B=31\)
\(\Rightarrow Z_A+\left(Z_A+1\right)=31\) \(\Rightarrow\left\{{}\begin{matrix}Z_A=15\\Z_B=16\end{matrix}\right.\)
Cấu hình electron:
A: [Ne]3s23p3
B: [Ne]3s23p4
A3-: [Ne]3s23p6
B2-: [Ne]3s23p6
Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là 3s², có A=24 a)Viết cấu hình electron nguyên tử đầy đủ của X b) số proton,số electron, số nơtron? c) viết kí hiệu nguyên tử ? d) số lớp electron và electron trong mỗi lớp? e) lớp nào có mức năng lượng cao nhất? f) cho biết phân lớp electron có mức năng lượng cao nhất? g) Nêu tính chất hoá học cơ bản của X và giải thích? h)Nguyên tố s,p,d hay f? Vì sao?
Viết cấu hình electron nguyên tử, xác định vị trí của chúng trong bảng tuần hoàn và dự đoán tính chất của các nguyên tố có số hiệu nguyên tử sau:
a) Na (Z = 11) b) Al (Z = 13)
c) S (Z = 16) d) Cl (Z = 17)
Na(Z=11) 1s2 2s2 2p6 3s1 thuộc ô thứ 11, chu kì 3, nhóm IA
Al(Z=13) 1s2 2s2 2p6 3s2 3p1 thuộc ô thứ 13, chu kì 3, nhóm IIIA
S(Z=16) 1s2 2s2 2p6 3s2 3p4 thuộc ô thứ 16, chu kì 3
Nhóm VIA
Cl(Z=17) 1s2 2s2 2p6 3s2 3p5 thuộc ô thứ 17, chu kì 3,
Nhóm VIIA
cho mình hỏi bài này làm sao vậy
Bài 1 : nguyên tử X có tổng số hạt các loại là 28 hạt . Số notron nhiều hơn số proton 1 hạt
a) xác định số hạt mỗi loại ?
b) tính số khối của hạt nhân nguyên tử X
c) viết cấu hình electron nguyên tử
d) nguyên tố X thuộc loại nguyên tố nào ( kim loại , phi kim , khí hiếm ) ?.
Bài 2 : nguyên tử của nguyên tố B có tổng số các hạt cấu tạo là 93 . Trong đó số hạt mang điện nhiều hơn không mang điện là 23 hạt .Xác định số hiệu nguyên tử của nguyên tố và viết cấu hình electron nguyên tử của nó .
Bài 3 : nguyên tử của nguyên tố A có tổng số các hạt cấu tạo là 40 . Xác định số hiệu nguyên tử của nguyên tố và viết cấu hình electron nguyên tử của nó .
ta co p+e+n=93 mà p=e=z => 2z+n=93
2z-n=23 ( vì số hạt mang điện nhiều hơn số hạt ko mang điện là 23)
tu 2 pt trên ta có z =29,,n=35
=> số hiệu nguyên tử của B = Z = 29
cấu hình electron
\(1s^22s^22p^63s^23p^64s^23d^9\)
đối với các dạng bài này , bạn cần nhớ kiến thức như sau :
Tổng số hạt trong nguyên tử = 2p + n ( gồm có 3 loại hạt : n , p, e trong đó p=e)
số hạt mang điện là 2p
số hạt không mang điện là n
số hiệu nguyên tử là Z= p = e = số thứ tự nhóm .
Sau khi xác định được p ,, tức là cũng xác định được e thì
cấu hình viết theo dãy trật tự các mức năng lượng
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10.......
Các nguyên tử có 1, 2, 3e ở lớp ngoài cùng là các nguyên tử kim loại, trừ H, He và B.Các nguyên tử có 5, 6, 7e ở lớp ngoài cùng thường là các nguyên tố phi kim. Các nguyên tử có 4e ở lớp ngoài cùng có thể là nguyên tử kim loại hoặc phi kim
bài 1 : a/
tacó p+e+n=28
<=> z+z+n=28
> 2z+n=28 1
vì n lớn hơn p là 1 nên ta có pt:
n-z=1hay -z+n=1 2
từ 1 và 2 ta có hệ phương trình
2z+n=28
-z+n=1
=>z= 9,n=10
b/ số khối A = Z + N = 9 + 10 = 19
c/ Cấu hình electron nguyên tử :\(1s^22s^22p^63s^23p^64s^1\)
d/ Nguyên tố X là kim loại cụ thể ở đây là Kali
1. Viết cấu hình electron nguyên tử của các nguyên tố (có số hiệu nguyên tử từ 1 đến 20).
\(Z=1\Rightarrow1s^1\)
\(Z=2\Rightarrow1s^2\)
\(Z=3\Rightarrow1s^22s^1\)
\(Z=4\Rightarrow2s^22s^2\)
\(Z=5\Rightarrow1s^22s^22p^1\)
\(Z=6\Rightarrow1s^22s^22p^2\)
\(Z=7\Rightarrow1s^22s^22p^3\)
\(Z=8\Rightarrow1s^22s^22p^4\)
\(Z=8\Rightarrow1s^22s^22p^4\)
\(Z=9\Rightarrow1s^22s^22p^5\)
\(Z=10\Rightarrow1s^22s^22p^6\)
\(Z=11\Rightarrow1s^22s^22p^63s^1\)
Hãy viết kí hiệu nguyên tử và cấu hình electron nguyên tử, từ đó xác định tính chất hóa học của nguyên tố trong các trường hợp sau: a. Nguyên tử có lớp electron ngoài cùng là 3s2 3p4 và có số nơtron bằng số proton. b. Nguyên tử có mức năng lượng cao nhất là 4s2 và có số khối gấp hai lần số proton. c. Điện tích hạt nhân của nguyên tử là +32.10-19(C ), số khối bằng 40. Câu 6. Nguyên tử của nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt. Viết cấu hình electron nguyên tố X và Y? Cho biết nguyến tố X, Y là kim loại, phi kim, khí hiếm? Vì sao? Câu 7. Phân tử X2Y3 có tổng số hạt electron là 50, số e trong ngtử X nhiều hơn trong ngtử Y là 5. Xác định số hiệu ngtử, viết cấu hình e của X, Y và sự phân bố theo obitan?
Xác định số hiệu và viết cấu hình electron nguyên tử của nguyên tố X từ các cơ sở sau:
Nguyên tử của nguyên tố X có tổng số electron ở các phân lớp s là 7, tổng số electron ở các phân lớp d là 7
Cấu hình: 1s22s22p63s23p63d74s1
=> Z= 26 (Sắt - Fe)
Cấu hình: 1s22s22p63s23p63d74s1
-> Z = 26 (Fe)
Viết cấu hình electron của nguyên tử các cặp nguyên tố mà hạt nhân nguyên tử có số proton là:
a) 1, 3.
b) 8, 16.
c) 7, 9.
Những nguyên tố nào là kim loại? là phi kim? Vì sao?
Hạt nhân nguyên tử cho biết số proton (nghĩa là cho biết số đơn vị điện tích hạt nhân) nên theo yêu cầu của đề bài ta có thể viết cấu hình electron của nguyên tử các cặp nguyên tố như sau:
a) Z = 1 : 1s1 ; Z = 3 : 1s22s1;
b) Z = 8 : 1s22s22p4 ; Z = 16: 1s22s22p63s23p4;
c) Z = 7 : 1s22s22p3 ; Z = 9: 1s22s22p5.
Nguyên tố kim loại có 1, 2, 3 electron lớp ngoài cùng, nên nguyên tố có Z = 3 là kim loại, còn nguyên tố Z = 1 là H giống kim loại nhưng không phải là kim loại.
Nguyên tố phi kim có 5, 6, 7 electron ở lớp ngoài cùng nên các nguyên tố có Z = 8, 16, 7, 9 là phi kim.
Nguyên tố X có tổng số hạt cơ bản là 34, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10
a) Hãy viết kí hiệu nguyên tử của ngtố X
b) Việt cấu hình electron nguyên tử, cấu hình electron theo orbital của X
c) Từ cấu hình electron, dự đoán tính chất hoá học
d) Xác đinh vị trí của X trong bảng tuần hoàn
a, Ta có: P + N + E = 34
Mà: P = E (Do nguyên tử trung hòa về điện.)
⇒ 2P + N = 34 (1)
Theo đề, số hạt mang điện nhiều hơn số hạt không mang điện là 10.
⇒ 2P - N = 10 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}P=E=11=Z\\N=12\end{matrix}\right.\) ⇒ A = 11 + 12 = 23
→ KH: \(^{23}_{11}X\)
b, Cấu hình e: 1s22s22p63s1
Cấu hình e theo orbital:
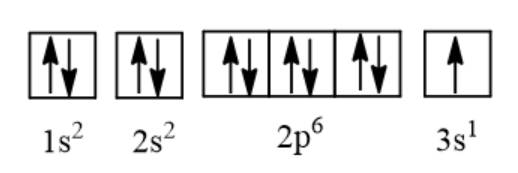
c, X có 1 e hóa trị → tính kim loại
d, - Z = 11 → ô số 11
- Có 3 lớp e → chu kỳ 3
- e cuối cùng phân bố ở phân lớp s, có 1 e hóa trị → nhóm IA
Vậy: X thuộc ô số 11, chu kỳ 3, nhóm IA
Một nguyên tử có số hiệu nguyên tử là 16. Hãy viết công thức biểu diễn cấu hình electron của nguyên tử đó.