cho 48 g lưu huỳnh cháy trong oxi thu đc 96 g khí sufuro tính khối lượng oxi tham gia phản ứng
Lưu huỳnh cháy theo sơ đồ phản ứng sau :
Lưu huỳnh + khí oxi → khí sunfuro
Nếu đốt cháy 48 gam lưu huỳnh và thu được 96 gam khí sunfuro thì khối lượng của oxi tham gia phản ứng là bao nhiêu?
Áp dụng định luật bảo toàn khối lượng, ta có :
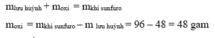
Lưu huỳnh cháy theo sơ đồ phản ứng sau: Lưu huỳnh + khí oxi → Lưu huỳnh đioxit Nếu đốt cháy 48 gam lưu huỳnh và thu được 96 gam lưu huỳnh đioxit thì khối lượng oxi đã tham gia vào phản ứng là bao nhiêu?
Theo ĐLBT KL, có: mS + mO2 = mSO2
⇒ mO2 = mSO2 - mS = 96 - 48 = 48 (g)
Lưu huỳnh cháy theo sơ đồ phản ứng sau: Lưu huỳnh + khí oxi → Lưu huỳnh đioxit Nếu đốt cháy 48 gam lưu huỳnh và thu được 96 gam lưu huỳnh đioxit thì khối lượng oxi đã tham gia vào phản ứng là bao nhiêu?
Đốt cháy 3,2 gam lưu huỳnh cháy trong không khí thu được 6,4 gam lưu huỳnh đioxit SO2. Tính khối lượng oxi đã tham gia phản ứng? Biết lưu huỳnh cháy là tham gia phản ứng với khí oxi.
Định luật bảo toàn khối lượng :
\(m_S+m_{O2}=m_{SO2}\)
3,2 + \(m_{O2}\) = 6,4
⇒ \(m_{O2}=6,4-3,2=3,2\left(g\right)\)
Chúc bạn học tốt
\(BTKL: \\ m_S+m_{O_2}=m_{SO_2}\\ 3,2+m_{O_2}=6,4\\ m_{O_2}=6,4-3,2=3,1(g)\)
Bài 3: Đốt cháy hoàn toàn 6,4 g bột lưu huỳnh trong không khí thu được lưu huỳnh trong không khí thu được lưu huỳnh dioxit( SO2)
.a. Tính khối lượng của chất tạo thành.
b. Tính thể tích khí oxi tham gia phản ứng ở điều kiện tiêu chuẩn.
Ta có: \(n_S=\dfrac{6,4}{32}=0,2\left(mol\right)\)
a. PTHH: S + O2 ---to---> SO2
Theo PT: \(n_{SO_2}=n_S=0,2\left(mol\right)\)
=> \(m_{SO_2}=0,2.64=12,8\left(g\right)\)
b. Theo PT: \(n_{O_2}=n_S=0,2\left(mol\right)\)
=> \(m_{O_2}=0,2.32=6,4\left(g\right)\)
a)S+O2-------->SO2
b)n S=6,4/32=0,2(mol)
Theo pthh
n SO2 =n S=0,2(mol)
V SO2=0,2.22,4=4,48(mol)
Cho 3,2g lưu huỳnh đốt cháy trong khí oxi. Sau phản ứng thu đc 1,12l khí SO2 ở đktc Tính thể tích khí oxi sau khi tham gia phản ứng
Đốt cháy lưu huỳnh trong oxi sau phản ứng thu được 4,48l khí sunfurơ (đktc)
a) viết phương trình phản ứng
b) tính khối lượng lưu huỳnh tham gia phản ứng cháy
c) tính thể tích (đktc) khí oxi cần thiết để phản ứng xảy ra hoàn toàn
S+O2-to>SO2
0,2--0,2----0,2 mol
n SO2=\(\dfrac{4,48}{22,4}\)=0,2 mol
=>m S=0,2.32=6,4g
=>VO2=0,2.22,4=4,48l
a. \(n_{SO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH : S + O2 -to> SO2
0,2 0,2 0,2
b. \(m_S=0,2.32=6,4\left(g\right)\)
c. \(V_S=0,2.22,4=44,8\left(l\right)\)
Lưu huỳnh cháy theo sơ đồ phản ứng sau: Lưu huỳnh + khí oxi → khí sunfurơ. Nếu đã có 32g lưu huỳnh cháy và thu được 64g khí sunfurơ thì khối lượng oxi đã tham gia phản ứng là
A.
32g
B.
48g
C.
40g
D.
44g
Theo ĐLBTKL, ta có:
mS + mO2 = mSO2
\(\Rightarrow m_{O_2}=64-32=32g\)
=> A
Câu 14: (1.5đ). Cho 3,2 gam lưu huỳnh cháy trong khí oxi sau phản ứng thu được khí sunfurơ (SO2 ) a. Lập phương trình phản ứng? b. Tính khối lượng oxi tham gia phản ứng và thể tích SO2 sinh ra ở (đktc). Cho biết : S =32 ; O2 =16
a) $S + O_2 \xrightarrow{t^o} SO_2$
b)
Theo PTHH :
$n_{O_2} = n_{SO_2} = n_S = \dfrac{3,2}{32} = 0,1(mol)$
$m_{O_2} = 0,1.32 = 3,2(gam)$
$V_{SO_2} = 0,1.22,4 = 2,24(lít)$
Ta có: n S = 3,2 / 32 = 0,1 ( mol )
PTHH: S + O2 \(\rightarrow\) SO2
0,1--0,1-----0,1
Theo pthh
n O2 = 0,1 ( mol ) => m O2 = 3,2 ( g )
n SO2 = 0,1 ( mol ) => V SO2 = 2,24 ( lít )