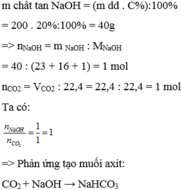dẫn 5,6 lit khí SO2 vào đ có chứa 18,5g Ca(OH)2. Sau phản ứng tạo ra sản phẩm nào
TT
Những câu hỏi liên quan
Dẫn 5,6 lit khí SO2 vào dung dịch có chứa 18,5g Ca(OH)2. Sau phản ứng tạo ra sản phẩm nào ?
Sục 22,4 lít khí SO2 (đktc) vào bình chứa 200 ml dung dịch Ca(OH)2 2M, sau khi phản ứng kết thúc thấy có V lít khí thoát ra (đktc). Giá trị của V là:
A. 4,48.
B. 5,6.
C. 6,72.
D. 7,84.
$n_{SO_2} = 1(mol) ; n_{Ca(OH)_2} = 0,4(mol)$
Ca(OH)2 + SO2 → CaSO3 + H2O
0,4...............0,4..........0,4.............................(mol)
CaSO3 + SO2 + H2O → Ca(HSO3)2
0,4............0,4...........................................(mol)
$\Rightarrow V = 22,4 - (0,4 + 0,4).22,4 = 4,48(lít)$
Đáp án A
Đúng 4
Bình luận (0)
). Dẫn 112 ml khí SO2 (đktc) đi qua 700 ml dung dịch Ca(OH)2 có nồng độ 0,01M, sản phẩm thu được là muối sunfit và nước.
a. Viết PTHH xảy ra?
b. Tính khối lượng các chất sau phản ứng?
\(a,PTHH:SO_2+Ca(OH)_2\to CaSO_3\downarrow+H_2O\\ b,n_{Ca(OH)_2}=0,7.0,01=0,007(mol)\\ n_{SO_2}=\dfrac{0,112}{22,4}=0,005(mol)\)
Vì \(\dfrac{n_{SO_2}}{1}<\dfrac{n_{Ca(OH)_2}}{1}\) nên \(Ca(OH)_2\) dư
\(\Rightarrow n_{CaSO_3}=n_{H_2O}=0,005(mol)\\ \Rightarrow m_{CaSO_3}=0,005.120=0,6(g)\\ m_{H_2O}=0,005.18=0,09(g)\)
Đúng 4
Bình luận (0)
Dẫn 1,12 l khí SO2 (đktc) đi qua 300ml dung dịch Ca(OH)2 có nồng độ 0,2 mol.
a) Viết phương trình phản ứng hóa học.
b) Tính khối lượng các chất sau phản ứng.
c) Tính nồng độ mol của sản phẩm sau phản ứng.
Số mol của khí lưu huỳnh đioxit
nSO2 = \(\dfrac{V_{SO2}}{22,4}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
300ml = 0,3l
Số mol của dung dịch canxi hidroxit
CMCa(OH)2 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=0,2.0,3=0,06\left(mol\right)\)
a) Pt : SO2 + Ca(OH)2 → CaSO3 + H2O\(|\)
1 1 1 1
0,05 0,06 0,05
b) Lập tỉ số so sánh : \(\dfrac{0,05}{1}< \dfrac{0,06}{1}\)
⇒ SO2 phản ứng hết , Ca(OH)2 dư
⇒ Tính toán dựa vào số mol SO2
Số mol của canxi sunfit
nCaSO3 = \(\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
Khối lượng của canxi sunfit
mCaSO3 = nCaSO3 . MCaSO3
= 0,05 . 120
= 6 (g)
Số mol dư của dung dịch canxi hidroxit
ndư = nban đầu - nmol
= 0,06 - (0,05.1)
= 0,01 (mol)
Khối lượng của dung dịch canxi hidroxit
mdư = ndư . MCa(OH)2
= 0,01 . 74
= 0,74 (g)
c) Thể tích của dung dịch sau phản ứng
Vdung dịch sau phản ứng= 1,12 + 0,3
= 1,42 (l)
Nồng độ mol của canxi sunfit
CMCaSO3 = \(\dfrac{n}{V}=\dfrac{0,05}{1,42}=0,04\left(M\right)\)
Nồng độ mol của dung dịch cnaxi hidroxit
CMCa(OH)2 = \(\dfrac{n}{V}=\dfrac{0,01}{1,42}=0,007\left(M\right)\)
Chúc bạn học tốt
Đúng 4
Bình luận (1)
Hấp thụ hoàn toàn 2,479L so2 (đkc) vào dung dịch nước vôi trong có chứa 0.075 mol Ca(OH)2. Sản phẩm thu được sau phản ứng gồm?
\(n_{SO_2}=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
\(\Rightarrow\dfrac{n_{SO_2}}{n_{Ca\left(OH\right)_2}}=\dfrac{0,1}{0,075}=\dfrac{4}{3}\) → Pư tạo CaSO3 và Ca(HSO3)2
Sản phẩm thu được: CaSO3, Ca(HSO3)2, H2O
Đúng 3
Bình luận (4)
Bài 1:Hấp thụ hoàn toàn 5,6 lit CO2 đktc vào 350ml dung dịch KOH 1M. Sau phản ứng muối nào được tạo thành? Khối lượng bao nhiêu?
Bài 2: Dẫn 33,6 lít CO2 đktc vào 444g dung dịch Ca(OH)2 10%. Tính khối lượng muối tạo thành.
Bài 3: Dẫn 3,36 lít CO2 đktc vào 350 ml NaOH 1M. Khi phản ứng kết thúc hãy cho biết.
a, Muối tạo thành là muối gì khối lượng là bao nhiêu gam.
b, Hoà tan hoàn toàn lượng muối thu được cần bao nhiêu g dung dịch HCl 8%
Đọc tiếp
Bài 1:Hấp thụ hoàn toàn 5,6 lit CO2 đktc vào 350ml dung dịch KOH 1M. Sau phản ứng muối nào được tạo thành? Khối lượng bao nhiêu?
Bài 2: Dẫn 33,6 lít CO2 đktc vào 444g dung dịch Ca(OH)2 10%. Tính khối lượng muối tạo thành.
Bài 3: Dẫn 3,36 lít CO2 đktc vào 350 ml NaOH 1M. Khi phản ứng kết thúc hãy cho biết.
a, Muối tạo thành là muối gì khối lượng là bao nhiêu gam.
b, Hoà tan hoàn toàn lượng muối thu được cần bao nhiêu g dung dịch HCl 8%
Dẫn 112 ml khí SO2 (đktc) đi qua 700 ml dung dịch Ca(OH)2 0,01M, sản phẩm thu được là muối canxi sunfit.
a) Chất nào còn dư và dư bao nhiêu mol? b) Tính khối lượng muối thu được sau phản ứng.
\(a,Ca\left(OH\right)2+SO2->CaSO3+H2O\)
\(=>\dfrac{\dfrac{0,112}{22,4}}{1}< \dfrac{0,7.0,01}{1}\)
=>Ca(OH)2 dư
\(=>nCa\left(OH\right)2\left(dư\right)=0,7.0.01-\dfrac{0,112}{22,4}=2.10^{-3}mol\)
b,\(=>nCaSO3=nSO2=5.10^{-3}mol=>mCaSO3=0,6g\)
Đúng 0
Bình luận (0)
112ml = 0,112l
Số mol của lưu huỳnh đioxit ở dktc
nSO2 = \(\dfrac{V_{SO2}}{22,4}=\dfrac{0,112}{22,4}=0,005\left(mol\right)\)
700ml = 0,7l
Số mol của dung dịch canxi hidroxit
CMCa(OH)2 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=0,01.0,7=0,007\left(mol\right)\)
Pt : SO2 + Ca(OH)2 → CaSO3 + H2O\(|\)
1 1 1 1
0,03 0,07 0,03
a) Lập tỉ số so sánh : \(\dfrac{0,03}{1}< \dfrac{0,07}{1}\)
⇒ SO2 phản ứng hết , Ca(OH)2 dư
⇒ Tính toán dựa vào số mol của SO2
Số mol dư của dung dịch canxi hidroxit
ndư = nban đầu - nmol
= 0,07 - (0,03 . 1)
= 0,04 (mol)
b) Số mol của muối canxi sunfit
nCaSO3 = \(\dfrac{0,03.1}{1}=0,03\left(mol\right)\)
Khối lượng của muối canxi sunfit
mCaSO3 = nCaSO3 . MCaSO3
= 0,03 . 120
= 3,6 (g)
Chúc bạn học tốt
Đúng 1
Bình luận (1)
Dẫn 22,4 lít khí
C
O
2
( đktc) vào 200g dung dịch NaOH 20%. Sau phản ứng tạo ra sản phẩm nào trong số các sản phẩm sau: A. Muối natricacbonat và nước B. Muối natri hidrocacbonat C. Muối natricacbonat D. Muối natrihiđrocacbonat và natricacbonat
Đọc tiếp
Dẫn 22,4 lít khí C O 2 ( đktc) vào 200g dung dịch NaOH 20%. Sau phản ứng tạo ra sản phẩm nào trong số các sản phẩm sau:
A. Muối natricacbonat và nước
B. Muối natri hidrocacbonat
C. Muối natricacbonat
D. Muối natrihiđrocacbonat và natricacbonat
Câu 15: (3,0 điểm) Dẫn 6,72 lít hỗn hợp khí gồm metan và etilen qua bình đựng dung dịch brom dư. Sau phản ứng thấy có một chất khí thoát ra khỏi bình. Đốt cháy chất khí này rồi dẫn sản phẩm cháy đi qua bình đựng dung dịch Ca(OH)2 dư, thấy tạo ra 20 gam kết tủa trắng.a) Viết các phương trình hóa học xảy ra.b) Tính thành phần phần trăm theo thể tích của mỗi khí có trong hỗn hợp ban đầu.c) Nếu cho toàn bộ sản phẩm sinh cháy vào dung dịch nước vôi trong dư, dung dịch thu được tăng hay giảm bao nhiêu...
Đọc tiếp
Câu 15: (3,0 điểm) Dẫn 6,72 lít hỗn hợp khí gồm metan và etilen qua bình đựng dung dịch brom dư. Sau phản ứng thấy có một chất khí thoát ra khỏi bình. Đốt cháy chất khí này rồi dẫn sản phẩm cháy đi qua bình đựng dung dịch Ca(OH)2 dư, thấy tạo ra 20 gam kết tủa trắng.
a) Viết các phương trình hóa học xảy ra.
b) Tính thành phần phần trăm theo thể tích của mỗi khí có trong hỗn hợp ban đầu.
c) Nếu cho toàn bộ sản phẩm sinh cháy vào dung dịch nước vôi trong dư, dung dịch thu được tăng hay giảm bao nhiêu gam? Biết rằng thể tích các khí đo ở đktc
a)
CH4 + 2O2 --to--> CO2 + 2H2O
C2H4 + 3O2 --to--> 2CO2 + 2H2O
b) Gọi số mol CH4, C2H4 là a, b (mol)
=> \(a+b=\dfrac{6,72}{22,4}=0,3\)
\(n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)\)
Khí thoát ra khỏi bình là CH4
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
a---------------->a
Ca(OH)2 + CO2 --> CaCO3 + H2O
0,2<------0,2
=> a = 0,2 (mol)
=> \(\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,2}{0,3}.100\%=66,67\%\\\%V_{C_2H_4}=100\%-66,67\%=33,33\%\end{matrix}\right.\)
c) b = 0,1 (mol)
CH4 + 2O2 --to--> CO2 + 2H2O
0,2--------------->0,2----->0,4
C2H4 + 3O2 --to--> 2CO2 + 2H2O
0,1----------------->0,2---->0,2
Ca(OH)2 + CO2 --> CaCO3 + H2O
0,4------>0,4
=> \(m_{CaCO_3}=0,4.100=40\left(g\right)\)
\(\left\{{}\begin{matrix}m_{CO_2}=44\left(0,2+0,2\right)=17,6\left(g\right)\\m_{H_2O}=\left(0,4+0,2\right).18=10,8\left(g\right)\end{matrix}\right.\)
Xét \(\Delta m=m_{CO_2}+m_{H_2O}-m_{CaCO_3}=17,6+10,8-40=-11,6\left(g\right)\)
=> Khối lượng dd giảm 11,6 gam
Đúng 3
Bình luận (0)