Tìm thể tích của dung dịch HCl 2M để trong đó có hòa tan 0,5mol HCl
LD
Những câu hỏi liên quan
Tìm thể tích của dung dịch NaOH 5M để trong đó có hòa tan 60g NaOH
\(n_{NaOH}=1,5\left(mol\right)\)
\(V=\dfrac{1,5}{5}=0,3\left(l\right)=300\left(ml\right)\)
Đúng 1
Bình luận (0)
\(n_{NaOH\left(ct\right)}=\dfrac{m_{NaOH}}{M_{NaOH}}=1,5\left(mol\right)\)
\(V_{ddNaOH}=\dfrac{n_{ctNaOH}}{C_{M_{NaOH}}}=0,3\left(l\right)\)
Đúng 1
Bình luận (0)
\(n_{NaOH}=\frac{60}{40}=1,5(mol)\\ V_{ddNaOH}=\frac{1,5}{5}=0,3(l)=300(ml)\)
Đúng 1
Bình luận (0)
Hòa tan 2,8g Fe bằng dung dịch HCl 2M vừa đủ, Tính thể tích dd HCl cần dùng
nFe = \(\dfrac{mFe}{MFe}\)=\(\dfrac{2,8}{56}=0,05mol\)
Fe+ 2HCl -> FeCl2 + H2
1 2 1 1
0,05->0,1->0,05->0,05
VddHCl = \(\dfrac{nHCl}{C_MHCl}\)=\(\dfrac{0,1}{2}=0,05l\)
Đúng 1
Bình luận (0)
Hòa tan hết 0,81 gam bột nhôm vào 550ml dung dịch HCl 0,2M thu được dung dịch A. Tính thể tích dung dịch NaOH 0,5M cần thêm vào dung dịch A để thu được lượng kết tủa lớn nhất.
A. 0,22l
B. 0.2l
C. 0,15l
D. 0,12l
Đáp án A
Số mol Al = 0.81/27= 0,03 (mol); số mol HCl = 0,55.0,2 = 0,11 (mol)
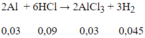
Dung dịch A thu được gồm AlCl3 = 0,03 mol; HCl = 0,11 - 0,09 = 0,02 mol.
Để có lượng kết tủa lớn nhất:
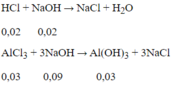
Thể tích dung dịch NaOH cần dùng
Đúng 0
Bình luận (0)
. Hòa tan 6,4 gam hỗn hợp gồm Mg, MgO vào dung dịch HCl 0,5M vừa đủ thu được dung dịch A và 2,24 lít khí (đktc).
a. Tính thành phần phần trăm về khối lượng của Mg, MgO trong hỗn hợp ban đầu.
b. Tính thể tích của dung dịch HCl đã dùng.
c. Tính nồng độ mol của dung dịch A.
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ Mg+2HCl\to MgCl_2+H_2\\ MgO+2HCl\to MgCl_2+H_2O\\ \Rightarrow n_{Mg}=0,1(mol)\\ \Rightarrow \%_{Mg}=\dfrac{0,1.24}{6,4}.100\%=37,5\%\\ \Rightarrow \%_{MgO}=100\%-37,5\%=62,5\%\)
\(b,n_{MgO}=\dfrac{6,4-0,1.24}{40}=0,1(mol)\\ \Rightarrow n_{HCl}=2.0,1+2.0,1=0,4(mol)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,4}{0,5}=0,8(l)\\ c,n_{MgCl_2}=0,1+0,1=0,2(mol)\\ \Rightarrow C_{M_{MgCl_2}}=\dfrac{0,2}{0,8}=0,25M\)
Đúng 2
Bình luận (0)
cho 546g kali oxit k2O tác dụng với nước thu được 0,25 lít dung dịch bazơ A viết PTHH B tính thể tích dung dịch HCL 20%, có khối lượng riêng 1,4g/ml cần dùng để trung hòa vs dung dịch bazơ nói trên
1. Công thức oxit ko đổi có dạng X2O3 biết rằng thành phần % trong oxit đó là 43,64% . Tìm X và gọi tên X .
2. Hòa tan 9,36g 1 oxit của 1 kim loại có hóa trị ko đổi cần dùng 260ml dung dịch HCL 1M . Tìm công thức oxit đó.
3. Hòa tan 6,2g Na2O vào 100ml H2O ( d=1g/ml ) thu đc dung dịch A . Viết PTHH xảy ra , tính nồng độ dd A
hòa tan hoàn toàn 13,2(g) hỗn hợp hai bột ZnO và Al2O3 vào 250 (ml) dung dịch HCl 2M (vừa đủ)
a) tính thành phần % theo khối lượng mỗi chất trong hỗn hợp
b) tính nồng độ mol của các muối trong dung dịch sau phản ứng (thể tích dung dịch thay đổi không đáng kể)
Bài 5. Tính tỉ lệ thể tích dung dịch HCl 18,25% (D = 1,2 g/ml) và thể tích dung dịch HCl 13% (D = 1,123 g/ml) để pha thành dung dịch HCl 4,5 M?
Ta có
CM(1) ddHCl 18,25%=\(\dfrac{13.1,123.10}{36,5}\)≈4(M)
Gọi V1,n1,V2,n2 là thể tích và số mol của dd HCl 6M và 4M
Ta có:
n1=6V1
n2=4V2
=>
Đúng 8
Bình luận (0)
Gọi thể tích dung dịch HCl 18,25% là a
⇒ mdung dịch HCl= 1,2.a (gam)
⇒ nHCl = (1,2a.18,25%):36,5 = 0,006a(mol)
Gọi thể tích dung dịch HCl 13% là b
⇒ m dung dịch HCl = 1,123b (mol)
⇒ nHCl= (1,123b.13%)/36,5 = 0,004b (mol)
Sau phản ứng,
Vdd = a + b=0,001a + 0,001b(lít)
⇒ CMHCl = (0,006a + 0,004b)/(0,001a + 0,001b) = 4,5M
⇒ a/b = 1/3
Đúng 4
Bình luận (2)
\(C_{M\left(HCl:18,25\%\right)}=\dfrac{C\%.10.D}{M}=\dfrac{18,25\%.10.1,123}{36,5}=0,05615M\)
\(C_{M\left(HCl:13\%\right)}=\dfrac{C\%.10.D}{M}=\dfrac{13\%.10.1,123}{36,5}=0,04M\)
Gọi \(\left\{{}\begin{matrix}V_{HCl\left(18,25\%\right)}=a\left(l\right)\\V_{HCl\left(13\%\right)}=b\left(l\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}n_{HCl\left(18,25\%\right)}=0,05615a\left(mol\right)\\n_{HCl\left(13\%\right)}=0,04b\left(mol\right)\end{matrix}\right.\)
\(V_{HCl\left(4,5M\right)}=a+b\left(l\right)\)
Ta có pt:
\(0,05615a+0,04b=4,5\left(a+b\right)\)
\(\Leftrightarrow\dfrac{a}{b}\approx-1\) Ủa đề lỗi à?
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn m gam Fe bằng dung dịch HNO3 thu được dung dịch X và 1,12 lít NO (đktc). Thêm dung dịch chứa 0,1 mol HCl vào dung dịch X thì thấy khí NO tiếp tục thoát ra và thu được dung dịch Y. Để phản ứng hết với các chất trong dung dịch Y cần 115 ml dung dịch NaOH 2M. Giá trị của m là A. 3,36 B. 4,2 C. 3,92 D. 3,08
Đọc tiếp
Hòa tan hoàn toàn m gam Fe bằng dung dịch HNO3 thu được dung dịch X và 1,12 lít NO (đktc). Thêm dung dịch chứa 0,1 mol HCl vào dung dịch X thì thấy khí NO tiếp tục thoát ra và thu được dung dịch Y. Để phản ứng hết với các chất trong dung dịch Y cần 115 ml dung dịch NaOH 2M. Giá trị của m là
A. 3,36
B. 4,2
C. 3,92
D. 3,08
Đáp án : C
Fe được hòa tan hoàn toàn bởi dd HNO3 thu được dd X, khi thêm HCl vào X có khí NO thoát ra → trong X có ion Fe2+ → HNO3 đã phản ứng hết
n(NO) = 1,12/22,4 = 0,05 mol
Fe + 4HNO3 → Fe(NO3)3 + NO + 4H2O
0,05 -> 0,2 -> 0,05
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
x -> 3x
Theo ĐL bảo toàn nguyên tố, số mol NO3- có trong muối:
n(NO3- trong muối) = n(HNO3) - n(NO) = 0,15 mol
n(NaOH) = 0,115.2 = 0,23 mol
Sau khi NaOH pư hoàn toàn với các chất trong dd Y, dung dịch thu được có:
n(Na+) = n(NaOH) = 0,23 mol; n(Cl-) = n(HCl) = 0,1 mol → n(NO3-) = n(Na+) - n(Cl-) = 0,23 - 0,1 = 0,13 mol → Số mol NO3- bị Fe2+ khử: 0,15 - 0,13 = 0,02 mol
NO3- + 3Fe2+ + 4H+ → 3Fe3+ + NO + 2H2O
0,02 -> 0,06 -> 0,08
NO3- và H+ đều dư (H+ dư 0,02mol) → Fe2+ đã phản ứng hết
→ 3x = 0,06 → x = 0,02 mol
Tổng số mol Fe: n(Fe) = 0,05 + x = 0,07 mol
Khối lượng Fe đã sử dụng: m(Fe) = 0,07.56 = 3,92g
Đúng 0
Bình luận (0)








